
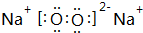
| A. | 钠、干冰 | B. | 金刚石、晶体硅 | ||
| C. | 碘化氢、溴化氢 | D. | 二氧化硅、二氧化碳 |
分析 一般情况下,不同类型的晶体,熔点:原子晶体>离子晶体>金属晶体>分子晶体;同种类型的晶体可根据影响晶体的因素分析.
解答 解:A.干冰为分子晶体,熔点最低,是分子间作用力,不是键能,故A错误;
B.晶体硅、金刚石都为原子晶体,原子半径C>Si,原子半径越小,共价键键能越大,则熔点越高,故B正确;
C.HI、HBr都为同主族元素所形成的分子晶体,分子的相对分子质量越大,分子间作用力越大,晶体的熔点越高,应为HI>HBr,而键能HBr>HI,故C错误;
D.二氧化碳是分子晶体,是分子间作用力,不是键能,故D错误.
故选B.
点评 本题考查晶体的熔沸点高低的比较,题目难度不大,注意比较晶体熔沸点高低的角度.


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案科目:高中化学 来源: 题型:解答题
| 族 周期 | |||||||
| ① | |||||||
| Li | C | ④ | ⑤ | ⑥ | |||
| ⑦ | ⑧ | ⑨ | ⑩ | ||||
| K | ⑫ | ⑬ | |||||
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食品中大量添加苯甲酸钠等防腐剂,可以有效延长其保持期 | |
| B. | 利用丁达尔效应可区分淀粉溶液和NaCl溶液 | |
| C. | 明矾能水解生成Al(OH)3胶体,可用作饮用水消毒杀菌 | |
| D. | 石油分馏属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅由实验②即可推断原混合溶液中一定存在Fe3+ | |
| B. | 要确定原混合溶液是否含有ClO- 至少需完成实验①②③ | |
| C. | 该溶液阳离子中一定存在Na+、Fe2+、Fe3+,一定不存在Al3+,无法确定是否含有K+ | |
| D. | 溶液中阴离子只有SO42-,且c(SO42-)大于2.75moL/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
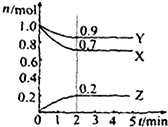 某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如图所示,图中数据分析:
某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如图所示,图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该气体一定是CO2 | |
| B. | 如果该气体无味,则该溶液中可能含CO32- | |
| C. | 如果该气体无味,则该溶液中可能含CO32-、HCO3-或者两者均有 | |
| D. | 如果该气体具有刺激性气味,则该溶液中可能含SO32-、HSO3-或者两者均有 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液:Na+、K+、SO42-、MnO4- | |
| B. | pH=1的溶液中:Fe2+、SO42-、Cl-、NO3- | |
| C. | 使酚酞变红的溶液:Na+、Cl-、SO42-、Fe3+、 | |
| D. | 水电离出的c(H+)=1×10-12mol/L的溶液:K+、Cl-、Ba2+、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ||
| 3 | ⑧ | ⑨ | ⑩ |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶质质量分数分别为a%和5a%的硫酸溶液按等体积混合,混合溶液中硫酸的质量分数大于3a% | |
| B. | 将1体积cmol/L硫酸溶液用水稀释为5体积,得到0.2cmol/L硫酸溶液 | |
| C. | 10mL质量分数14%的氨水,用水稀释至100mL,氨水的质量分数小于1.4% | |
| D. | 将w g a% NaCl溶液蒸发掉$\frac{w}{2}$ g水,得到4a% NaCl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com