
 (1)已知下热化学方程式:
(1)已知下热化学方程式:分析 (1)①燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,液态的水、二氧化碳是稳定氧化物,据此分析解答;
②由①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol,据此计算10g H2生成液态水,放出的热量;
③利用盖斯定律,结合反应③④求得;
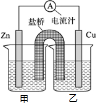
(2)盐桥原电池中,金属电极插入含有本金属阳离子的盐溶液里,电解质里的阳离子移向正极,阴离子移向负极,据此回答.
解答 解:(1)①燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,由④C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol,二氧化碳是稳定氧化物,且C的物质的量为1mol,所以-393.5kJ/mol是C的燃烧热,①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol,液态水是稳定的产物,且氢气的物质的量为1mol,所以-285.8kJ/mol是氢气的燃烧热,①
故答案为:-285.8kJ/mol;-393.5kJ/mol;
②根据H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol,得到10g H2生成液态水,放出的热量为=285.8kJ×5=1429kJ;故答案为:1429kJ;
③已知:a.C(s)+$\frac{1}{2}$O2 (g)=CO (g)△H=-110.5kJ/mol
b.C(s)+O2 (g)=CO2 (g)△H=-393.5kJ/mol
据盖斯定律,b-a得:CO(g)+$\frac{1}{2}$O2 (g)=CO2 (g)△=-283KJ/mol,所以CO的燃烧热是-283KJ/mol,其热化学方程式为:CO(g)+$\frac{1}{2}$O2 (g)=CO2 (g)△=-283KJ/mol,
故答案为:-283KJ/mol;CO(g)+$\frac{1}{2}$O2 (g)=CO2 (g)△=-283kJ/mol;
(2)Zn+CuSO4=Cu+ZnSO4,设计成原电池,Zn是负极,Cu是正极,为减小能量损失,金属电极插入含有本金属阳离子的盐溶液里,Cu插入硫酸铜中,电解质里的阳离子移向正极,氯离子等阴离子移向负极,即氯离子移向锌电极,故答案为:乙;甲.
点评 本题考查了根据热化学方程式的计算以及盖斯定律的应用、盐桥原电池的构成以及原电池的工作原理知识,注意知识的归纳和梳理是解题的关键,难度中等.


 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:填空题
 如图甲、乙是电化学实验装置.请回答下列问题:
如图甲、乙是电化学实验装置.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 2:2:3 | C. | 3:3:2 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应过程中,分子的种类和数目一定发生改变 | |
| B. | 化学反应涉及化学键的断裂和生成,而且还伴随着能量的变化 | |
| C. | 化学反应速率的大小主要取决于反应物的本身性质 | |
| D. | CO2(g)+C(s)?2CO(g)△H>0,△S>0,该反应常温下不能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
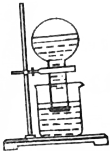 甲同学按如图所示装置做新制氯水受日光照射分解放出O2的验证实验,结果现象不明显.
甲同学按如图所示装置做新制氯水受日光照射分解放出O2的验证实验,结果现象不明显.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作(或设计) | 实验现象 | 结论 |
| A | 向溶液中滴加经盐酸酸化的BaCl2溶液 | 溶液中产生白色沉淀 | 溶液中含有SO42- |
| B | 以镁、铝、氢氧化钠溶液构成原电池 | 镁表面有气泡产生 | 镁作原电池的负极 |
| C | 加热盛有NH4Cl固体的试管 | 试管底部固体消失,试管口有晶体凝结 | NH4Cl固体可以升化 |
| D | 向KI溶液中滴入少量溴水和苯,振荡、静置 | 上层溶液呈紫红色 | I-的还原性强于Br- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
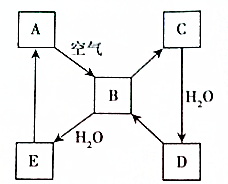 如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.
如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+、Na+、Al3+、Cu2+ |
| 阴离子 | OH-、HCO3-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com