(1)向20.00mL稀氨水中逐滴加入等物质的量浓度的盐酸,请回答相关问题:
①当加入10.00mL盐酸时,溶液中各种离子浓度之间的大小关系为(请在括号中填入离子符号):c______>c______>c______>c______
②当盐酸与氨水等物质的量反应时,溶液的pH______7(填“>”或“<”或“=”,下同)
③当溶液pH=7时,反应所消耗的物质(包括还在溶液中存留的物质)之间的关系为:n______n(HCl),溶液中c( NH4+)______c(Cl-).
(2)已知某弱酸的酸式酸根离子HB-既能发生电离,又能发生水解,请通过实验确定HB-离子是电离程度大还是水解程度大?请简述实验过程和结论.____________.
【答案】分析:(1)①判断反应后,溶液中的溶质,再根据电离与盐类水解解答;
②盐酸与氨水恰好反应,为氯化铵溶液,利用盐类水解规律判断溶液酸碱性;
③利用电荷守恒判断出c( NH4+) 与c(Cl-)大小关系,再根据溶液中存在平衡 NH4++H2O?NH3?H2O判断;
(2)对于弱酸的酸式酸根离子,若电离程度大于水解程度,溶液呈酸性;若电离程度小于水解程度,则溶液呈碱性,若电离程度等于水解程度,溶液呈中性,据此解答.
解答:解:(1)①当加入10.00mL盐酸后,溶液为等物质的量浓度的氨水与氯化铵的混合液,氨水电离使呈碱性,氯化铵水解使溶液呈酸性,等物质的量浓度,电离程度大于水解程度,溶液呈碱性,即:c( OH-)>c(H+);
根据电荷守恒有:(NH4+)+c(H+)=c(Cl-)+( OH-),溶液呈碱性,所以,c(NH4+)>c(Cl-);
水解程度微弱,溶液中c(Cl-)远远大于c( OH-),
故溶液中各种离子浓度之间的大小关系为c(NH4+)>c(Cl-)>c( OH-)>c(H+).
故答案为:c(NH4+)>c(Cl-)>c( OH-)>c(H+)
②盐酸与氨水恰好反应,为氯化铵溶液,氯化铵是强酸弱碱盐,故溶液呈酸性,即PH<7
故答案为:<
③根据电荷守恒:c(NH4+)+c(H+)=c(Cl-)+c( OH-),由于溶液pH=7,即c( OH-)=c(H+),所以c(NH4+)>c(Cl-),溶液中存在平衡 NH4++H2O?NH3?H2O,根据物料守恒有,反应所消耗的物质(包括还在溶液中存留的物质)之间的关系为:n(NH3?H2O)>n(HCl).
故答案为:>;=
(2)用pH试纸测NaHB溶液的pH值,若pH>7,说明HB-水解程度大于其电离程度;若pH=7,说明其水解程度等于其电离程度;如果pH<7,则说明其水解程度小于其电离程度.
故答案为:用pH试纸测NaHB溶液的pH,若pH>7,说明HB-水解程度大于其电离程度;若pH=7,说明其水解程度等于其电离程度;如果pH<7,则说明其水解程度小于其电离程度.
点评:离子浓度大小比较的等式关系,主要根据“三大守恒”,即电荷守恒、物料守恒和质子守恒.



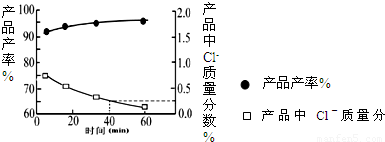
 KH2PO4(aq)+HCl(aq),当反应时间不同时,产品产率和产品中Cl?含量变化情况如图所示.KDP晶体的一级品标准:Cl-质量分数低于0.2%.
KH2PO4(aq)+HCl(aq),当反应时间不同时,产品产率和产品中Cl?含量变化情况如图所示.KDP晶体的一级品标准:Cl-质量分数低于0.2%.

 KH2PO4(aq)+HCl(aq),当反应时间不同时,产品产率和产品中Cl?含量变化情况如图所示.KDP晶体的一级品标准:Cl-质量分数低于0.2%.
KH2PO4(aq)+HCl(aq),当反应时间不同时,产品产率和产品中Cl?含量变化情况如图所示.KDP晶体的一级品标准:Cl-质量分数低于0.2%.