
| A. | 惰性电极电解硝酸银溶液不可能在电极上生成银,因为银可以溶于硝酸 | |
| B. | 25℃,惰性电极电解氢氧化钠溶液,溶液PH不变,因为实质是电解水 | |
| C. | 惰性电极电解足量硫酸铜溶液一段时间加入氧化铜固体可使电解质恢复到电解前 | |
| D. | 惰性电极电解淀粉碘化钾溶液,可看到阴极区域溶液变蓝 |
分析 A.Ag在阴极析出,而硝酸在阳极得到,氢离子向阴极移动,而硝酸根不向阴极移动;
B.惰性电极电解氢氧化钠溶液,因为实质是电解水,溶液碱性增强;
C.电解总反应式为:2H2O+2CuSO4$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,相当于析出CuO,加入氧化铜固体可使电解质恢复到电解前;
D.阴极发生还原反应,水放电生成氢气与氢氧根离子.
解答 解:A.Ag在阴极析出,而硝酸在阳极得到,氢离子向阴极移动,而硝酸根不向阴极移动,Ag不能溶解,故A错误;
B.惰性电极电解氢氧化钠溶液,因为实质是电解水,溶液碱性增强,溶液pH增大,故B错误;
C.电解总反应式为:2H2O+2CuSO4$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,相当于析出CuO,加入氧化铜固体可使电解质恢复到电解前,故C正确;
D.阴极发生还原反应,水放电生成氢气与氢氧根离子,阳极发生氧化反应,碘离子在阳极放电生成碘单质,则阳极区域溶液变蓝,故D错误,
故选:C.
点评 本题考查电解原理,关键是明确离子放电顺序、电解原理,难度中等.


科目:高中化学 来源: 题型:选择题
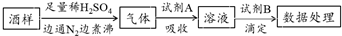
| A. | 葡萄酒中加亚硫酸盐的主要目的是防止氧化,利用了亚硫酸盐的还原性 | |
| B. | 通入N2和煮沸的目的是为了将产生的气体从溶液中全部赶出 | |
| C. | 若试剂A选择氯水,则试剂B可选择NaOH标准液 | |
| D. | 若试剂A选择碱液,调节吸收后溶液为中性,则试剂B可选择I2标准液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实 验 步 骤 | 实 验 结 论 |
| (1)将9.0g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过足量的浓硫酸和碱石灰,发现两者分别增重5.4g和13.2g. | (1)A的实验式为CH2O. |
| (2)通过质谱法测得其相对分子质量为90. | (2)A的分子式为C3H6O3. |
| (3)另取9.0g A,跟足量的NaHCO3粉末反应,生成2.24L CO2(标准状况),若与足量金属钠反应则生成2.24L H2(标准状况). | (3)A中含有的官能团名称为羧基、羟基. |
| (4)A的核磁共振氢谱有四组吸收峰,其峰面积之比为2:2:1:1. | (4)综上所述,A的结构简式为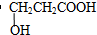 . .(5)写出A与NaHCO3反应的化学方程式 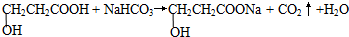 . . |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Na<Cl | B. | 热稳定性:HCI<HF | ||
| C. | 离子半径:F-<Mg2+ | D. | 碱性:NaOH<Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
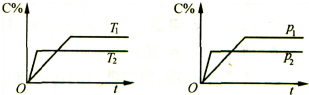
| A. | Tl>T2,△H<O | B. | Tl<T2,△H<O | C. | Pl>P2,a+b>c | D. | Pl<P2,a+b>c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol强酸和1 mol强碱完全反应所放出的热量称为中和热 | |
| B. | 热化学方程式中表明的热量是指每摩尔反应物反应时吸收或放出的热量 | |
| C. | 1 mol碳燃烧所放出的热量为燃烧热 | |
| D. | 热化学方程式中的化学计量数表示物质的量,因此可用分数表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 试管内壁附着的硫黄可以用热的KOH溶液洗涤,也可以用CS2洗涤 | |
| B. | 盛Na2SO3、Na2S溶液的试剂瓶不能用玻璃塞,贮存时应盖好瓶塞,防止被空气氧化 | |
| C. | 金属镁着火可使用扑救金属火灾的专用干粉灭火剂灭火,但不可用泡沫灭火器灭火 | |
| D. | 从硫酸亚铁铵溶液中获取硫酸亚铁铵晶体,可以用蒸发结晶,也可以用冷却结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
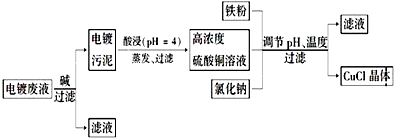
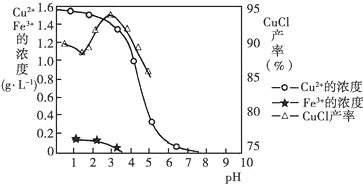
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ① | B. | ② | C. | ③ | D. | ④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com