
【题目】某兴趣小组探究SO2气体还原Fe3+、I2 , 他们使用的药品和装置如下图所示:
(1)SO2气体还原Fe3+生成的还原产物是(填离子符号),参加反应的SO2 和Fe3+的物质的量之比是 .
(2)下列实验方案适用于在实验室制取所需SO2的是(双选,填序号).
A.Na2SO3溶液与HNO3
B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧
D.铜与热浓H2SO4
(3)装置C的作用是 .
(4)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有(双选,填序号).A蒸发皿 B 石棉网 C 漏斗 D 烧杯 E 玻璃棒 F 坩埚
(5)在上述装置中通入过量的SO2 , 为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:方案①:往第一份试液中加入KMnO4溶液,紫红色褪去.
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红.
方案③:往第三份试液加入用稀盐酸酸化的BaCl2 , 产生白色沉淀.
上述方案不合理的一个是 , 原因是 .
(6)上述装置中能表明I﹣的还原性弱于SO2的现象是 .
【答案】
(1)Fe2+;1:2
(2)BD
(3)吸收SO2尾气,防止污染空气
(4)BF
(5)方案①;因为A的溶液中含有SO2 , SO2也能使KMnO4溶液褪色
(6)B中蓝色溶液褪色
【解析】解:(1)2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+ , SO2气体还原Fe3+生成的还原产物是Fe2+ , 参加反应的SO2和Fe3+的物质的量之比等于计量数之比为1:2,所以答案是:Fe2+;1:2;(2)A、硝酸具有强氧化性,把亚硫酸钠氧化成硫酸钠,得不到二氧化硫,故A错误;
B、浓硫酸虽具有强氧化性性,但不能氧化亚硫酸钠,和亚硫酸钠发生复分解反应生成二氧化硫气体,故B正确;
C、固体硫在纯氧中燃烧,操作不容易控制,故C错误;
D、Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O,可以制备得到二氧化硫气体,故D正确,
CuSO4+SO2↑+2H2O,可以制备得到二氧化硫气体,故D正确,
故选BD,
所以答案是:BD;(3)二氧化硫是酸性氧化物具有刺激性气味,直接排放污染大气,能和碱反应生成盐和水,所以可用碱液处理二氧化硫,所以装置C的作用是吸收SO2尾气,防止污染空气,
所以答案是:吸收SO2尾气,防止污染空气;(4)操作步骤:蒸发需用到A 蒸发皿,E.玻璃棒,冷却结晶需用到烧杯,过滤需用到C.漏斗,D.烧杯,E.玻璃棒,故不需要B.石棉网、F.坩埚,
所以答案是:BF;(5)二氧化硫有还原性,高锰酸钾有强氧化性,二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,Fe2+也使高锰酸钾溶液褪色,所以不合理的是方案①,因为A的溶液中含有SO2 , SO2也能使KMnO4溶液褪色,
所以答案是:方案①,因为A的溶液中含有SO2 , SO2也能使KMnO4溶液褪色;(6)I2+SO2+2H2O=2HI+H2SO4二氧化硫能使含有碘的淀粉溶液褪色,说明发生了氧化还原反应,碘是氧化剂,二氧化硫是还原剂,还原剂的还原性大于还原产物的还原性,所以答案是:B中蓝色溶液褪色.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母X等表示)原子半径的相对大小、最高正价或最低负价的变化如图1所示.
根据判断出的元素回答问题:
(1)z在元素周期表的位置是 .
(2)比较d、f简单离子的半径大小(用化学符号表示,下同)>;比较d、g元素的简单气态氢化物的稳定性大小> .
(3)任选上述元素组成一种四原子共价化合物,写出其电子式 .
(4)已知1mol固体e的单质在足量d2气体中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式 .
(5)由上述元素组成的离子化合物 Q:eh 和W:e2gd4 , 若电解含2molQ和2molW的混合水溶液,当阳极产生44.8L气体(标准状况下,且不考虑气体的溶解和损失)时,电路中转移电子的物质的量为mol.
(6)上述元素可组成盐R:zx4f(gd4)2 . 向盛有10mL1molL﹣1R溶液的烧杯中滴加1molL﹣1 NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如图2:①R溶液中,离子浓度由大到小的顺序是 .
②写出m点发生反应的离子方程式 .
③若在R溶液中改加20mL 1.2molL﹣1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化如图所示,则下列对混合烃的判断正确的是( ) 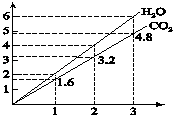
①可能有C2H4
②一定有CH4
③一定有C3H8
④一定没有C2H6
⑤可能有C2H6
⑥可能有C2H2 .
A.②⑤⑥
B.①②④
C.④⑥
D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4gH2O和8.8gCO2,消耗氧气6.72L(标准状况下).有机物A的实验式为;
(2)质谱仪测定有机化合物A的相对分子质量为46,A的核磁共振氢谱如图所示,则A的结构简式为; 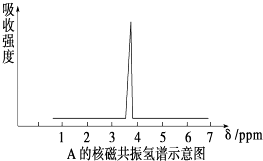
(3)A的同分异构体B属于醇,则23g B 与足量的金属钠反应产生的气体在在标准状况下的体积为L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下: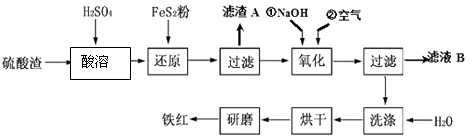
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为;“滤渣A”主要成份的化学式为 .
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+ , 而本身被氧化为H2SO4 , 请完成该反应的离子方程式:FeS2+14Fe3++H2O═15Fe2++SO ![]() + .
+ .
(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为 .
(4)为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是(几种离子沉淀的pH见下表);滤液B可以回收的物质有(写化学式) .
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有Na+、Al3+、Cl-、SO42- 四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+和 SO42-的离子个数比为( )
A.1∶2B.1∶4C.3∶4D.3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备硅单质时,主要化学反应如下:
(1)SiO2+2C ![]() Si(粗硅)+2CO
Si(粗硅)+2CO
(2)Si(粗)+2Cl2 ![]() SiCl4
SiCl4
(3)SiCl4+2H2 ![]() Si (纯)+4HCl
Si (纯)+4HCl
对上述三个反应叙述中,不正确的是( )
A.(1)(3)为置换反应
B.(1)(2)(3)均为氧化还原反应
C.(2)为化合反应
D.反应物中硅元素均被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施能减慢化学反应速率的是( )
A.用Zn和2molL﹣1H2SO4反应制取H2时,向溶液中滴加少量CuSO4溶液
B.日常生活中,将食物贮藏在冰箱中
C.用过氧化氢溶液制氧气时添加少量二氧化锰粉末
D.用相同质量的锌粉替代锌粒与同浓度、同体积的盐酸反应制氢气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com