
【题目】(1)单质钠是一种______色的金属,密度比水______![]() 大
大![]() 小
小![]() ,钠在自然界中以______
,钠在自然界中以______![]() 化合
化合![]() 游离
游离![]() 态存在;金属钠与水反应的化学方程式:______,金属钠在空气中燃烧生成______色的______
态存在;金属钠与水反应的化学方程式:______,金属钠在空气中燃烧生成______色的______![]() 化学式
化学式![]() ,其生成物与水反应的化学方程式:______。
,其生成物与水反应的化学方程式:______。
(2)氯气是一种______色的气体,密度比空气______,______溶于水,并可以和水发生反应,写出其反应的化学方程式:______,实验室中用______溶液![]() 化学式
化学式![]() 吸收多余的氯气。
吸收多余的氯气。
铁丝在氯气中燃烧的化学方程式:______。漂白粉是______和______![]() 化学式
化学式![]() 的混合物,是利用氯气与氢氧化钙反应制成的,写出其反应的方程式:______。
的混合物,是利用氯气与氢氧化钙反应制成的,写出其反应的方程式:______。
(3)现有物质:①氧化镁②硫酸铜③碳酸钙④金属钠⑤氯气⑥氢气⑦硫酸⑧氯水⑨二氧化硫⑩氧化钠![]() 二氧化硅
二氧化硅![]() 次氯酸
次氯酸![]() 漂白粉
漂白粉
按下列标准进行归类![]() 填序号
填序号![]() 混合物______酸______盐______单质______碱性氧化物______酸性氧化物______。
混合物______酸______盐______单质______碱性氧化物______酸性氧化物______。
【答案】银白 小 化合 ![]() 淡黄
淡黄 ![]()
![]() 黄绿 大 易
黄绿 大 易 ![]() NaOH
NaOH 
![]()
![]()
![]() ⑧
⑧![]() ⑦
⑦![]() ②③ ④⑤⑥ ①
②③ ④⑤⑥ ①![]() ⑨
⑨![]()
【解析】
![]() 钠观察切开面,新切开的金属钠断面呈银白色色;密度比水小,钠是很活泼的金属,在自然界中只能以化合态存在;金属钠与水反应生成氢氧化钠和氢气;
钠观察切开面,新切开的金属钠断面呈银白色色;密度比水小,钠是很活泼的金属,在自然界中只能以化合态存在;金属钠与水反应生成氢氧化钠和氢气;
金属钠在空气中燃烧生成淡黄色的过氧化钠,过氧化钠可以和水之间发生反应生成氢氧化钠和氧气;
![]() 在通常状况下,氯气是一种黄绿色气体,密度比空气大,易溶于水;氯气和水反应生成盐酸和次氯酸,实验室用氢氧化钠吸收吸收多余的氯气,铁丝在氯气中燃烧生成氯化铁,氯气与氢氧化钙反应生成漂白粉,漂白粉的主要成分是次氯酸钙、氯化钙;
在通常状况下,氯气是一种黄绿色气体,密度比空气大,易溶于水;氯气和水反应生成盐酸和次氯酸,实验室用氢氧化钠吸收吸收多余的氯气,铁丝在氯气中燃烧生成氯化铁,氯气与氢氧化钙反应生成漂白粉,漂白粉的主要成分是次氯酸钙、氯化钙;
![]() 物质分为混合物和纯净物,纯净物又分为单质和化合物,化合物分为氧化物、酸、碱、盐。混合物是指由多种物质组成的物质;酸是指电离时产生的阳离子全部是氢离子的化合物;盐是指由金属离子和酸根离子组成的化合物;单质是只含有一种元素的纯净物;氧化物是指由两种元素组成的化合物中,其中一种元素是氧元素,碱性氧化物是指能和酸反应生成盐和水的氧化物,酸性氧化物是指能和碱反应生成盐和水的氧化物。
物质分为混合物和纯净物,纯净物又分为单质和化合物,化合物分为氧化物、酸、碱、盐。混合物是指由多种物质组成的物质;酸是指电离时产生的阳离子全部是氢离子的化合物;盐是指由金属离子和酸根离子组成的化合物;单质是只含有一种元素的纯净物;氧化物是指由两种元素组成的化合物中,其中一种元素是氧元素,碱性氧化物是指能和酸反应生成盐和水的氧化物,酸性氧化物是指能和碱反应生成盐和水的氧化物。
![]() 钠观察切开面,新切开的金属钠断面呈银白色色;钠与水反应浮在水面上,钠的密度比水小,钠是很活泼的金属,在常温下就能与氧气反应,钠在自然界中只能以化合态存在;金属钠与水反应生成氢氧化钠和氢气,反应的化学方程式:
钠观察切开面,新切开的金属钠断面呈银白色色;钠与水反应浮在水面上,钠的密度比水小,钠是很活泼的金属,在常温下就能与氧气反应,钠在自然界中只能以化合态存在;金属钠与水反应生成氢氧化钠和氢气,反应的化学方程式:![]() ,金属钠在空气中燃烧生成淡黄色的过氧化钠,
,金属钠在空气中燃烧生成淡黄色的过氧化钠, ,过氧化钠可以和水之间发生反应生成氢氧化钠和氧气,方程式为:
,过氧化钠可以和水之间发生反应生成氢氧化钠和氧气,方程式为:![]() ;
;
![]() 在通常状况下,氯气是一种黄绿色气体,密度比空气大,易溶于水,1体积水中能溶解2体积的氯气;氯气和水反应生成盐酸和次氯酸,
在通常状况下,氯气是一种黄绿色气体,密度比空气大,易溶于水,1体积水中能溶解2体积的氯气;氯气和水反应生成盐酸和次氯酸,![]() ,实验室用氢氧化钠吸收吸收多余的氯气,生成氯化钠和次氯酸钠,离子反应为
,实验室用氢氧化钠吸收吸收多余的氯气,生成氯化钠和次氯酸钠,离子反应为![]() ,铁丝在氯气中燃烧生成氯化铁
,铁丝在氯气中燃烧生成氯化铁 ,氯气与石灰乳反应生成氯化钙和次氯酸钙,反应的方程式为
,氯气与石灰乳反应生成氯化钙和次氯酸钙,反应的方程式为![]() ,漂白粉的主要成分是次氯酸钙
,漂白粉的主要成分是次氯酸钙![]() 、氯化钙
、氯化钙![]() ;漂白粉溶于水后,受空气中的
;漂白粉溶于水后,受空气中的![]() 作用,即产生有漂白、杀菌作用的次氯酸,同时生成碳酸钙沉淀,反应的化学方程式为:
作用,即产生有漂白、杀菌作用的次氯酸,同时生成碳酸钙沉淀,反应的化学方程式为:![]() ;
;
![]() 氧化镁为碱性氧化物;
氧化镁为碱性氧化物;![]() 硫酸铜由硫酸根离子和铜离子构成的盐;
硫酸铜由硫酸根离子和铜离子构成的盐;![]() 碳酸钙由碳酸根离子和钙离子构成的盐;
碳酸钙由碳酸根离子和钙离子构成的盐;![]() 金属钠属于单质;
金属钠属于单质;![]() 氯气属于单质;
氯气属于单质;![]() 氢气属于单质;
氢气属于单质;![]() 硫酸属于二元强酸;
硫酸属于二元强酸;![]() 氯水属于氯气和水的混合物;
氯水属于氯气和水的混合物;![]() 二氧化硫为酸性氧化物;
二氧化硫为酸性氧化物;![]() 氧化钠为碱性氧化物;
氧化钠为碱性氧化物;![]() 二氧化硅为酸性氧化物;
二氧化硅为酸性氧化物;![]() 次氯酸为一元弱酸;
次氯酸为一元弱酸;![]() 漂白粉主要成分是次氯酸钙
漂白粉主要成分是次氯酸钙![]() 、氯化钙
、氯化钙![]() ,属于混合物;
,属于混合物;
则:混合物为![]() ,酸为
,酸为![]() ,盐为
,盐为![]() ,单质为
,单质为![]() ,碱性氧化物为
,碱性氧化物为![]() ,酸性氧化物为
,酸性氧化物为![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列哪种说法可以证明反应N2+3H2![]() 2NH3已达到平衡状态( )
2NH3已达到平衡状态( )
A.1个N≡N键断裂的同时,有3个H—N键形成
B.1个N≡N键断裂的同时,有3个H—H键断裂
C.1个N≡N键断裂的同时,有6个H—N键断裂
D.1个N≡N键断裂的同时,有6个H—N键形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 0.1000 mol/L NaOH溶液滴定 20.00mL 0.1000 mol/L CH3COOH溶液所得滴
定曲线如图。下列说法不正确的是
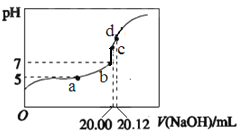
A. a点所示溶液中:c(Na+)=c(CH3COOH) + c(CH3COO-)
B. b和c点所示溶液中:c(OH-)-c(H+)=c(Na+)-c(CH3COO-)
C. d点所示溶液中:c(Na+) >c(CH3COO-) >c(OH-) >c(H+)
D. 滴定过程中可能出现:c(CH3COOH) >c(CH3COO-) >c(H+)> c(Na+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.浓硫酸与铁加热反应后,铁片有剩余,生成的气体除水蒸气外为![]()
B.用干燥且洁净的玻璃棒蘸取NaClO溶液,滴到放在表面皿上的pH试纸上测pH值
C.工业上电解熔融氯化铝可得到金属铝
D.使用滴定管时水洗后需润洗,但容量瓶水洗后不用润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不属于可逆反应的是( )
A.氯气与水反应生成HCl与HClO
B.N2与H2在一定条件下可以生成NH3,同时NH3又可分解为N2和H2
C.电解水生成H2和O2,氢气和氧气燃烧生成H2O
D.SO2溶于水生成H2SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛(22Ti)由于其特殊的性能被誉为“未来世纪的金属”。钛铁矿主要成分为FeTiO3(含有少量MgO、SiO2等杂质),Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿来制备,工艺流程如下:
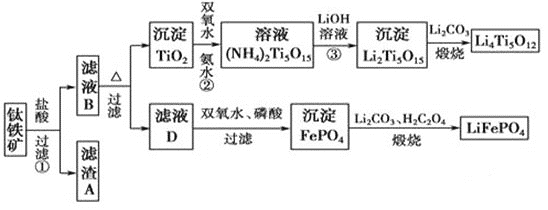
⑴钛铁矿在预处理时需要进行粉碎,其原因是__________________________________。
⑵过程①中,铁的浸出率结果如图所示。由图可知,当铁的浸出率为80%时,所采用的实验条件是_________________________。

⑶过程②中固体TiO2与双氧水、氨水反应转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度关系如图所示,反应温度过高时,Ti元素浸出率下降的原因是_______________________。
⑷写出由滤液D生成FePO4的离子方程式_____________________________________________
⑸由流程图可知FePO4制备LiFePO4的化学方程式是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_____、_____(填标号)。
A. B.
B.
C.![]() D.
D.![]()
(2)Li+与H具有相同的电子构型,r(Li+)小于r(H),原因是______。
(3)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是______、中心原子的杂化形式为______。LiAlH4中,存在_____(填标号)。
A.离子键 B.σ键 C.π键 D.氢键
(4)Li2O是离子晶体,其晶格能可通过图(a)的BornHaber循环计算得到。
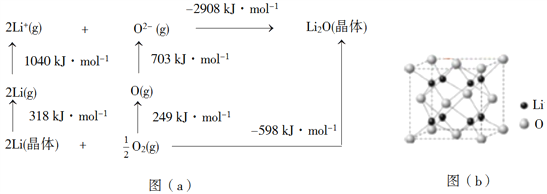
可知,Li原子的第一电离能为________kJ·mol1,O=O键键能为______kJ·mol1,Li2O晶格能为______kJ·mol1。
(5)Li2O具有反萤石结构,晶胞如图(b)所示。已知晶胞参数为0.4665 nm,阿伏加德罗常数的值为NA,则Li2O的密度为______g·cm3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一容积固定的密闭容器中,加入1molCO2、2molH2进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),下列情况能说明反应一定达到平衡状态的是( )
CO2(g)+H2(g),下列情况能说明反应一定达到平衡状态的是( )
A.容器内混合物的相对分子质量不再随时间改变
B.生成1molH—H键的同时消耗1molCO2
C.容器内的气体总压强不再随时间改变
D.容器内CO2与H2的浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。能表明反应达到平衡状态的叙述是( )
Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。能表明反应达到平衡状态的叙述是( )
A. 容器内的总压强不随时间变化
B. 断裂4molH—O键的同时,断裂2molH—H键
C. 混合气体分子的总数不变
D. 反应不再进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com