
| ||
| ||
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
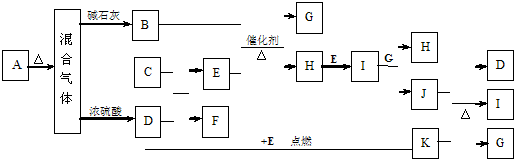
查看答案和解析>>
科目:高中化学 来源: 题型:
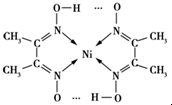 分子内的作用力有
分子内的作用力有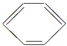 、④HCHO等,其中碳原子采用sp2杂化的分子有
、④HCHO等,其中碳原子采用sp2杂化的分子有查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠在空气中燃烧产生黄色火焰,生成淡黄色固体物质 |
| B、新制氯水呈浅黄绿色,氯水放置数天后pH将变大 |
| C、铁与稀盐酸反应生成氯化亚铁,而铁与氯气反应则生成三氯化铁 |
| D、漂白粉的有效成分是次氯酸钙,它具有漂白性是因为在水溶液中生成了有强氧化性的次氯酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| A、△H1>0,△S2>0 |
| B、△H3<0,△S3>0 |
| C、△H1+△H5=△H2+△H3 |
| D、△H3<△H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲、乙是两种常见的化合物,X、Y、Z是三种常见的单质.下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )
甲、乙是两种常见的化合物,X、Y、Z是三种常见的单质.下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )| 选项 | X | Y | Z | 甲 | 乙 |
| A | C | H2 | O2 | H2O | CO |
| B | Zn | Fe | Cl2 | Fe Cl2 | ZnCl2 |
| C | Mg | C | O2 | CO2 | MgO |
| D | H | Si | Cl2 | SiCl4 | HCl |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
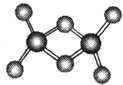 科学家合成了一种稳定的氢铝化合物,其熔点为150℃,可用作高能燃料或储氢材料.Al2H6的球棍模型如图所示.下列说法不正确的是( )
科学家合成了一种稳定的氢铝化合物,其熔点为150℃,可用作高能燃料或储氢材料.Al2H6的球棍模型如图所示.下列说法不正确的是( )| A、Al2H6可以燃烧,产物为氧化铝和水 |
| B、Al2H6是共价化合物 |
| C、Al2H6中所有原子在同一平面 |
| D、Al2H6是非极性分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com