
二氧化锰在生产、生活中有广泛应用。
(1)锌—锰碱性电池广泛应用于日常生活。电池的总反应式为
Zn(s)+2MnO2(s)+2H2O(l)===Zn(OH)2(s)+2MnOOH(s)。
该电池的正极反应式为 。
(2)某学习小组拟以废旧干电池为原料制取锰,简易流程如下:
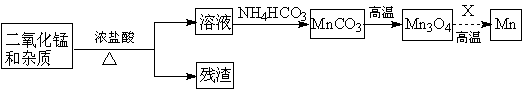
①加入浓盐酸溶于废旧电池内黑色物质过程中保持通风,其原因是 。
②从产品纯度、环保等角度考虑,X宜选择 (填代号)。
A.焦炭 B.铝 C.氢气 D.一氧化碳
③写出碳酸锰在空气中灼烧生成四氧化三锰的化学方程式 。
(3)电解硫酸锰溶液法制锰又叫湿法冶锰。以菱锰矿(主要成份是MnCO3,主要杂质是Fe2+、Co2+、Ni2+)为原料制备锰的工艺流程如下:
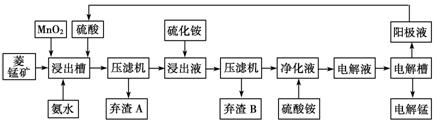
已知:NiS 、CoS均难溶于水。部分氢氧化物的pH如下表:(若某离子浓度小于等于105mol·L1,则认为完全沉淀)
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 | 2.7 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 | 3.8 |
①用离子方程式表示加入二氧化锰的作用 。
②加入氨水调节浸出槽中溶液的pH范围: 。
③弃渣B可能含有的物质为 。
④电解槽阴极的电极反应式为 。
【答案】
(1)MnO2+H2O+e=MnOOH+OH(2分)
(2)①二氧化锰与浓盐酸反应会产生有毒的氯气(2分)② C(1分)
③ 6MnCO3+O2 2Mn3O4+6CO2(3分)
2Mn3O4+6CO2(3分)
(3)①MnO2+4H+2Fe2=2Fe3++Mn2++2H2O(2分)
②3.8≤pH<8.3(2分)
③NiS、CoS(2分)
④Mn2++2e=Mn(2分)
【解析】
(1)根据电池反应式直接写出正极反应式,或写出负极反应式:Zn-2e+2OH=Zn(OH)2;
电池反应式减去负极反应式得正极反应式MnO2+H2O+e=MnOOH+OH。
(2)①浓盐酸与二氧化锰反应产生氯气,氯气是有毒气体。故用浓盐酸溶解二氧化锰时要保持通风,避免中毒。②焦炭、铝还原四氧化三锰时产品中混有固体杂质,CO有毒,易污染环境。宜用氢气还原四氧化三锰。③碳酸锰在空气中灼烧时有氧气参与反应。
(3)①根据几种离子沉淀的pH数据知,氢氧化亚铁沉淀过程中,氢氧化锰已开始沉淀,因此,要将亚铁离子转化成铁离子。②在此pH范围内Co2+、Ni2+可能没有完全沉淀,加入硫化铵溶液用于沉淀多余Co2+、Ni2+。用惰性电极材料电解硫酸锰溶液时,阴极上锰离子发生还原反应,阳极上发生氧化反应:2H2O -4e=4H++O2↑,阳极区生成了硫酸,硫酸循环使用。


 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
下列有关NaClO和NaCl混合溶液的叙述正确的是:
A.该溶液中,H+、NH4+、SO42-、Br-可以大量共存
B.该溶液中,Ag+、K+、NO3-、CH3CHO可以大量共存
C.向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:
2Fe2++ClO-+2H+=== Cl-+2Fe3++H2O
D.向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于右图所示转化关系(X代表卤素)的说法错误的是
A.2H(g)+2X(g)=2HX(g) ΔH3<0
B.ΔH1=ΔH2 + ΔH3
C.Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量
按Cl、Br、I的顺序依次增多
D.途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl
比HBr稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
浙江大学成功研制出能在数分钟之内将电量充满的锂电池,其成本只有传统锂电池的一半。若电解液为LiAlCl4-SOCl2,电池的总反应为:4Li+2SOCl2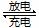 4LiCl+S+SO2。下列说法不正确的是
4LiCl+S+SO2。下列说法不正确的是
A.Li为电池的负极
B.电池的电解液可用LiCl水溶液代替
C.放电时电子从负极经外电路流向正极
D.充电时阳极反应式为:4Cl-+S+SO2-4e-=2SOCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列反应所画图象错误的是( )
| A | B | C | D |
| 将二氧化硫通入 到一定量氯水中 | 将氨水滴入到一定 量氯化铝溶液中 | 将铜粉加入到 一定量浓硝酸中 | 将铁粉加入到一 定量氯化铁溶液中 |
|
|
|
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
草酸亚铁晶体(FeC2O4·2H2O)是一种浅黄色固体,难溶于水,受热易分解,是生产锂电池的原材料,也常用作分析试剂及显影剂等,其制备流程如下:
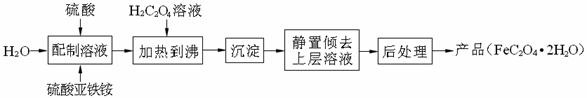
(1)配制(NH4)2Fe(SO4)2·6H2O溶液时,需加少量硫酸,目的是 。
(2)沉淀时发生反应的化学方程式为_____________________________________________________。
(3)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液的颜色由紫红色变为棕黄色,同时有气体生成。这说明草酸亚铁晶体具有_________(填“氧化”或“还原”)性。若反应中消耗1mol FeC2O4·2H2O,则参加反应的n(KMnO4)为__________。
(4)三草酸合铁酸钾晶体K3[Fe(C3O4 )3]·3H2O
(5)称取3.60g草酸亚铁晶体(摩尔质量是180g·mol-1)用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示:
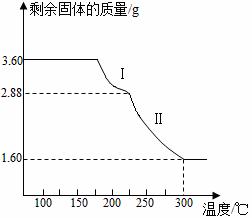
①过程Ⅰ发生反应的化学方程式为 。
②300℃时剩余固体是铁的一种氧化物,试通过计算确定该氧化物的化学式 (写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生活、生产、环境等社会实际密切相关。下列叙述正确的是( )
A.稀的食盐水能杀死H7N9禽流感病毒
B.涤纶、塑料、光导纤维都是有机高分子材料
C.用电镀厂的废水直接灌溉农田,可提高水的利用率
D.外形似海绵、密度小、有磁性的碳与石墨互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验设计能够成功的是( )
| 选项 | 实验目的 | 实验步骤及现象 |
| A | 检验亚硫酸钠试样是否变质 | 试样 |
| B | 检验某盐是否为铵盐 | 试样 |
| C | 证明酸性条件下H2O2氧化性比I2强 | NaI溶液 |
| D | 除去氯化钠晶体中少量硝酸钾 | 试样
|
查看答案和解析>>
科目:高中化学 来源: 题型:
取100mL的Na2CO3和Na2SO4混合溶液,加入适量Ba(OH)2溶液100 mL后,恰好完全反应,过滤、干燥后得到14.51g白色沉淀和滤液,再用过量稀硝酸处理沉淀,最后减少到4.66g,并有气体放出。计算:
(1)原混合液中Na2SO4的物质的量浓度为_________ mol ·L-1。
(2)产生的气体在标准状况下的体积为___________ L。
(3)过滤出沉淀后,计算所得滤液的物质的量浓度(设反应后溶液的体积为200mL)。(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com