
分析 (1)根据热化学方程式的书写方法书写,吸热反应中焓变为正值;
(2)先写出反应的化学方程式并标明物质状态,然后根据放热反应焓变为负值写出反应的热化学方程式;
(3)根据热化学方程式的书写方法解答,化学计量数与反应热成正比,并注意标明物质的聚集状态,吸热反应中焓变为正值;
(4)0.5mol N2和1.5molH2置于密闭的容器中充分反应生成0.5mol NH3(g),放热19.3kJ,则1molN2和3molH2置于密闭的容器中充分反应生成NH3(g),放热是38.6kJ,然后根据放热反应焓变为负值写出反应的热化学方程式;
(5)20g氢氧化钠的物质的量是0.5mol,0.5mol完全中和生成0.5mol水放出28.7kJ的热量,则生成1mol水放出57.4kJ的能量,据此写出热化学方程式.
解答 解:(1)1molC与1mol水蒸气反应生成1mol CO和1mol H2,吸收131.5kJ的热量,则热化学方程式为:C(S)+H2O(g)?CO(g)+H2(g)△H=+131.5kJ•mol-1,
故答案为:C(S)+H2O(g)?CO(g)+H2(g)△H=+131.5kJ•mol-1;
(2)CO(g)还原1mol Fe2O3(s)放热24.8KJ,则反应的热化学方程式为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol,
故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol;
(3)1mol HgO(s)分解生成液态汞和氧气时,吸热90.7kJ,标注物质聚集状态和对应焓变得到热化学方程式为:HgO(s)=Hg(l)+$\frac{1}{2}$O2(g)△H=+90.7 kJ/mol;
故答案为:HgO(s)=Hg(l)+$\frac{1}{2}$O2(g)△H=+90.7 kJ/mol;
(4)0.5mol N2和1.5molH2置于密闭的容器中充分反应生成0.5mol NH3(g),放热19.3kJ,则1molN2和3molH2置于密闭的容器中充分反应生成NH3(g),放热是38.6kJ,热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ/mol,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ/mol;
(5)20g氢氧化钠的物质的量是0.5mol,0.5mol完全中和生成0.5mol水放出28.7kJ的热量,则生成1mol水放出57.4kJ的能量,所以该反应的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.4kJ/mol,
故答案为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.4kJ/mol.
点评 本题主要考查了热化学方程式的书写,题目难度不大,注意掌握书写热化学方程式的方法:标注物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:填空题
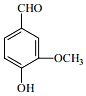 香荚兰豆的香气成分中含有的香草醛(如图)也称香兰素,常用做食品添加剂的原料,起着增香作用.请回答下列问题:
香荚兰豆的香气成分中含有的香草醛(如图)也称香兰素,常用做食品添加剂的原料,起着增香作用.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数都是7 | B. | 从F2到I2,氧化性逐渐增强 | ||
| C. | 从F2到I2,颜色逐渐加深 | D. | 熔、沸点:F2<Cl2<Br2<I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
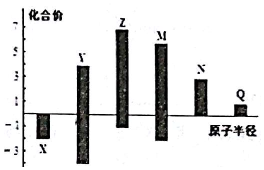
| A. | 金属性:N>Q | |
| B. | 最高价氧化物对应水化物酸性:M>Y>N | |
| C. | 简单离子半径:Q>N>X | |
| D. | 原子序数:Z>M>X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 目前我国流通的硬币是由合金材料制造的 | |
| B. | 镁在空气中燃烧发出耀眼的白光,可用于制作照明弹 | |
| C. | 出土的古代铜制品表面覆盖着铜绿其主要成分为 CuO | |
| D. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com