
【题目】将4mol甲烷与氯气发生取代反应,待反应完全后甲烷与氯气均无剩余,测知四种取代物物质的量相同,则消耗的氯气( )
A. 2molB. 10molC. 7.5molD. 16 mol
科目:高中化学 来源: 题型:
【题目】(1)下列实验操作或叙述正确的是___________(填字母)。
A. 向饱和苯酚钠溶液中,不断通入足量二氧化碳气体,溶液最终呈浑浊
B. 用金属钠检验无水乙醇中含有的少量水
C.除去乙烷中少量的乙烯:与适量的氢气混合加热,把乙烯转化为乙烷
D.向苯酚浓溶液中滴入少量浓溴水可观察到白色的三溴苯酚沉淀
E.用氨水洗去试管内壁的银镜
F.证明氯乙烷分子中含有氯原子,可将氯乙烷溶于AgNO3的HNO3溶液中
G.乙醇与氢溴酸的反应中断裂了O-H 键
H. 甲醛与苯酚制取酚醛树脂的反应属于聚合反应
I.实验室制取乙烯气体时,将温度计的水银球放入液面下
(2)化合物A(C4H8Br2)可由下列反应制得,C4H10O![]() C4H8
C4H8![]() C4H8Br2,则A的结构式不可能的是(______)
C4H8Br2,则A的结构式不可能的是(______)
A.CH3CH2CHBrCH2Br B.CH3CH(CH2Br)2 C.CH3CHBrCHBrCH3 D.(CH3)2CBrCH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法中正确的是
A.46gNO2和N2O4的混合气体中含有的原子个数为3NA
B.常温常压下,17gNH3含有NA个N-H共价键
C.1molFe与S恰好完全反应,转移的电子数为3NA
D.标况下,2.24LH2O含有的质子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可利用“甲烷蒸气转化法”生产氢气,反应的热化学方程式为CH4(g)+H2O(g)CO2(g)+3H2(g) △H=+161.1kJ·mol-1
(1)已知温度、压强对甲烷平衡时的体积分数的影响如图1,请回答:

①图1中a、b、c、d四条曲线中的两条代表压强分别为1MPa、2MPa时甲烷体积分数的曲线,其中表示1MPa的是_____。
②该反应的平衡常数:K(600℃)___(填“>”“<”或“=”)K(700℃)。
(2)①已知:在700℃、1MPa时,1molCH4与1molH2O在1L的密闭容器中反应,6min时达到平衡(如图2),此时CH4的转化率为__,该温度下反应的平衡常数为____(结果保留小数点后一位数字)。
②从图2分析,由第一次平衡到第二次平衡,平衡移动的方向是____(填“向正反应方向”或“向逆反应方向”)移动,采取的措施可能是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水综合利用要符合可持续发展的原则,其联合工业体系(部分)如图所示,下列说法错误的是

A.①中可采用蒸馏法B.②中可通过电解法制金属镁
C.③中提溴涉及到复分解反应D.④的产品可生产盐酸、漂白液等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核磁共振是利用在有机物中的1H的原子核所处的“化学环境”(即其附近的基团)不同,表现出的核磁性不同,代表核磁性特征的峰在核磁共振谱图中横坐标的位置(化学位移,符号为δ)也就不同。下图所示的核磁共振图谱表示的是下列有机物中的( )

A. CH3C(CH3)3B. CH3CH2CH3
C. CH2=CHCH3D. (CH3)2CHCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是重要的化工原料,可以制得多种有机制品。用乙炔为原料制备PI(聚异戊二烯)的流程如图:
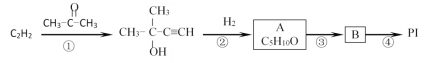
(1)有机物A中官能团的名称___,反应③的反应条件____。
(2)若将①中反应物“![]() ”改为“乙醛”,经过②③④后得到产物的结构简式是__。
”改为“乙醛”,经过②③④后得到产物的结构简式是__。
乙炔在一定条件下还可合成PVB塑料(聚乙烯醇缩丁醛):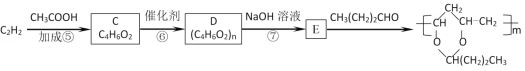
已知:-CHO+ +H2O
+H2O
(3)写出C的结构简式为__;2分子乙炔也能发生加成反应得到链烃,其反应产物的结构简式为___。
(4)反应⑦的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是一种重要的化工原料,工业上采用氨催化氧化法制备,生产过程中发生的反应有:
NH3(g)+![]() O2(g)
O2(g)![]() NO(g)+
NO(g)+![]() H2O(l) △H1= -292.3kJ/mol
H2O(l) △H1= -292.3kJ/mol
NO(g)+![]() O2(g)= NO2(g) △H2= -57.1kJ/mol
O2(g)= NO2(g) △H2= -57.1kJ/mol
3NO2(g)+ H2O(l)=2HNO3(aq)+NO(g) △H3= -71.7kJ/mol
回答以下问题:
(1) NH3(g)+2O2(g)=HNO3(aq)+ H2O(l) 的 △H= ___________ kJ/mol。原料气体(NH3、O2)在进入反应装置之前,必须进行脱硫处理。其原因是____。
(2)研究表明2NO(g)+ O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
(a)2NO(g)![]() N2O2(g)(快) (b)N2O2(g)+ O2(g)
N2O2(g)(快) (b)N2O2(g)+ O2(g)![]() 2NO2(g)(慢)
2NO2(g)(慢)
①该反应的速率由b步决定,说明b步反应的活化能比a步的 ___(填“大”或“小”)。
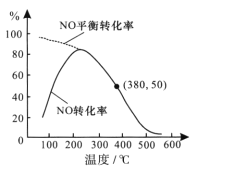
②在恒容条件下,NO和O2的起始浓度之比为2:1,反应经历相同时间,测得不同温度下NO转化为NO2的转化率如图,则150℃时,v正___ v逆(填“>”或“<”)。若起始c(O2)=5.0×10-4mol/L,则380℃下反应达平衡时c(O2)=____mol/L。
(3) T1温度时,在容积为2L的恒容密闭容器中发生反应2NO+ O2![]() 2NO2,实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。容器中各反应物和生成物的物质的量随时间变化如下图所示:
2NO2,实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。容器中各反应物和生成物的物质的量随时间变化如下图所示:
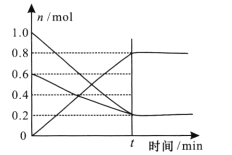
①下列说法能表明该反应已经达到平衡状态的是 ____填序号)
A. 混合气体的密度不变 B. 混合气体的颜色不变
C. k正、k逆不变 D. 2v正(O2)=v逆(NO2)
②化学平衡常数K与速率常数k正、k逆的数学关系式K=____。
③温度为T1时的化学平衡常数K= _____。若将容器的温度变为T2时,k正=k逆,则T2 ___T1(填“>
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】难溶性杂卤石(K2SO4MgSO42CaSO42H2O)在水中存在如下平衡K2SO4MgSO42CaSO42H2O (s)![]() 2Ca2++2K++ Mg2++4SO42-+2H2O,为能充分利用钾资源,用足量的饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾。工艺流程是:首先需要溶浸与分离,见下图:
2Ca2++2K++ Mg2++4SO42-+2H2O,为能充分利用钾资源,用足量的饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾。工艺流程是:首先需要溶浸与分离,见下图:
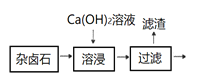
(1)不同温度下,K+的浸出浓度与溶浸时间的关系如下图,由图可得,随着温度升高①________________;②______________。

(2)为了提高浸出效率,可采取的措施是:________;过滤用到的玻璃仪器名称是:______。
(3)滤渣主要成分有_________和_________以及未溶杂卤石,用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石、浸出K+的原因: _________________________________。
(4) 溶浸与分离过滤后,滤液中的主要杂质离子是______,进一步“除杂”环节见下图。可先加入______溶液,经搅拌等操作后,过滤,再加入_________溶液调滤液pH至中性。
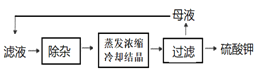
(5)中过滤得到的母液中含有大量的_____(填写化学式),检验其中溶质阴离子的方法是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com