
| A. | Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 用氯化铁溶液和沸水反应制取氢氧化铁胶体:Fe3++3H2O(沸水)═Fe(OH)3↓+3H+ | |
| D. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- |
分析 A.反应生成硫酸钠、硫酸钡和水;
B.电子、电荷不守恒;
C.生成胶体,不是沉淀;
D.反应生成碳酸钙和HClO.
解答 解:A.Ba(OH)2溶液中滴加NaHSO4溶液至中性的离子反应为Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故A正确;
B.钠与水反应的离子反应为2Na+2H2O=2Na++2OH-+H2↑,故B错误;
C.用氯化铁溶液和沸水反应制取氢氧化铁胶体的离子反应为Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+,故C错误;
D.漂白粉溶液在空气中失效的离子反应为Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 若已知上述反应为放热反应,升高温度,其平衡常数减小 | |
| B. | 上述反应中每生成1molSi3N4,转移12mol电子 | |
| C. | 在氮化硅的合成反应中,N2是氧化剂,SiO2是还原剂 | |
| D. | 若使压强增大,上述平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
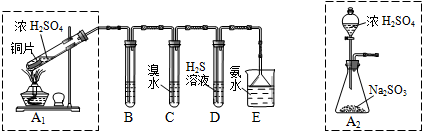
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取l mol/L BaCl2溶液向小烧杯滴加直至过量. | 若出现白色浑浊,则溶液中存在SO32-或 SO42-. |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体滴入1滴品红,再滴入过量2 mol/L盐酸,振荡 用试管取适量滤液,向其中滴入过量l mol/LBa(OH)2溶液(或1滴品红,再滴入2-3滴2 mol/L盐酸),振荡. 步骤3: | 若品红褪色(或有气泡)则存在SO32- 若出现白色沉淀(或品红褪色或有气泡),则存在HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl得电子能力相同 | |
| D. | F-、O2-、Mg2+、Na+半径逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

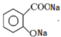
| 试剂 | 沸点(℃) | 溶解度 | 化学性质 |
| 乙酸酐 | 139 | 在水中逐渐分解 | 略 |
| 乙酰水杨酸 | 略 | 微溶于水 | 与碳酸钠反应生成水溶性盐 |
| 水杨酸 | 211 | 微溶于冷水,易溶于热水 | 略 |
| 乙酸 | 117.9 | 略 | 略 |
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4molH2O | B. | 0.2mol H2SO4 | C. | 0.8molHCl | D. | 0.3molHNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L lmol•L-1 FeBr2溶液与lmol氯气反应时转移的电子数为3NA | |
| B. | 0.5 mol•L-1硫酸钠溶液中含有溶质离子总数为1.5NA | |
| C. | 1mol硫酸氢钠固体中含阳离子总数NA | |
| D. | 28g由乙烯和聚乙烯组成的混合气体中含有碳碳双键数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2CO3?H++HCO3-; HCO3-?H++CO32- | B. | H2SO4═2H++SO42- | ||
| C. | NaHS═Na++H++S2- | D. | CH3COOH?H++CH3COO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com