
【题目】一定条件下,在体积为10 L的密闭容器中,1 mol A和1 mol B进行反应:2A(g)+B(g)![]() 2C(g),经60 s达到平衡,生成0.6 mol C。下列说法正确的是
2C(g),经60 s达到平衡,生成0.6 mol C。下列说法正确的是
A. 以A浓度变化表示的反应速率为0.001 mol·L-1·s-1
B. 其他条件不变,将容器体积变为5 L,C的平衡浓度变为原来的2倍
C. 其他条件不变,若增大压强,则物质A的转化率减小
D. 达到平衡时,C的体积百分含量为0.353
科目:高中化学 来源: 题型:
【题目】在标准状况下![]()
![]()
![]() 个HCl分子
个HCl分子 ![]()
![]()
![]()
![]() ,下列对这四种气体的关系从大到小表达正确的是( )
,下列对这四种气体的关系从大到小表达正确的是( )
![]() 体积
体积![]() 密度
密度![]()
![]() 电子总数
电子总数![]() 原子总数
原子总数![]()
A. abcdB. bcdC. acdD. abc
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A用质谱仪测定如图1,核磁共振氢谱示意图如图2,则A的结构简式可能为( )
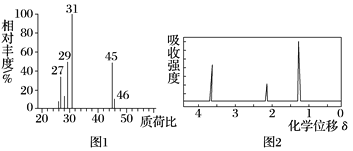
A. C2H5OHB. CH3CH2CHO
C. CH3OCH3D. CH3CH2CH2COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+。现将硫酸酸化的K2Cr2O7溶液与FeSO4 溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是
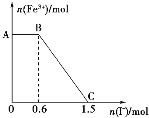
A. 图中AB段的氧化剂为K2Cr2O7
B. 图中BC段发生的反应为2Fe3++2I-=2Fe2++I2
C. 若将上述过程中的KI溶液换为K3[Fe(CN)6]溶液,则AB段有蓝色沉淀生成
D. 开始加入的K2Cr2O7为0.25 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个体积均为1.0L的恒容密闭容器中发生反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。达到平衡时,下列说法正确的是
2SO3(g) ΔH<0。达到平衡时,下列说法正确的是
容器 | 温度/℃ | 物质的起始浓度/mol·L-1 | 物质的平衡浓度/mol·L-1 | ||
c(SO2) | c(O2) | c(SO3) | c(SO3) | ||
Ⅰ | 758 | 0.2 | 0.1 | 0 | 0.044 |
Ⅱ | 758 | 0.1 | 0.05 | 0 | |
Ⅲ | 858 | 0.2 | 0.1 | 0 | |
A. 从开始至平衡时,容器Ⅰ中SO3的反应速率为0.044 mol·L-1·s-1
B. 平衡时,容器Ⅱ中SO3的浓度小于0.022mol·L-1
C. 平衡时,容器Ⅲ中SO3的浓度大于0.044mol·L-1
D. 若起始时,向容器Ⅰ中充入0.02mol SO2、0.01mol O2和0.02mol SO3,则反应向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L的密闭容器内,500℃时反应2SO2(g)+O2(g) ![]() 2SO3(g)ΔH<0体系中,n(SO2)随时间的变化如表:
2SO3(g)ΔH<0体系中,n(SO2)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=______________________。
(2)下图表示SO3的变化的曲线是__________。用O2表示从0~2s内该反应的平均速率v=______________。

(3)能说明该反应已达到平衡状态的是________。
a.v(SO3)=2v(O2) b.容器内压强保持不变
c.v逆(SO2)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出SO3气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
(5)若在容积均为2 L的密闭容器内,500℃时按不同方式投入反应物,发生反应2SO2(g)+O2(g)![]() 2SO3(g)ΔH=-QkJ·mol-1(Q>0),保持恒温恒容。初始投料与各容器达到平衡时的有关数据如下:
2SO3(g)ΔH=-QkJ·mol-1(Q>0),保持恒温恒容。初始投料与各容器达到平衡时的有关数据如下:
实验 | 甲 | 乙 | 丙 |
初始投料 | 2molSO2、 1molO2 | 2molSO3 | 4molSO2、 2molO2 |
平衡时n(SO3) | 0.5mol | n2 | n3 |
反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
体系的压强 | p1 | p2 | p3 |
反应物的转化率 | α1 | α2 | α3 |
三个容器中的反应分别达平衡时下列各组数据关系正确的是____(填字母)。
A.α1+α2=1 B. Q1+Q2=Q C. α3<α1 D. p3<2p1=2p2 E. n2<n3<1.0mol F. Q3=2Q1
(6)在一定条件下进行反应2SO2(g)+O2(g) ![]() 2SO3(g),如图所示。
2SO3(g),如图所示。
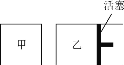
相同温度下,在甲、乙两容器中各投入2molSO2、1molO2,甲、乙两容器的初始体积均为1L,甲、乙容器达到平衡所用时间:甲____(填“>”、“<”或“=”,下同)乙,平衡时SO2的转化率:甲____乙。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用氢氧化钠固体配制1.0mol·L-1的氢氧化钠溶液240mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却 ⑨摇动
其正确的操作顺序为___。必须用到的玻璃仪器有烧杯、胶头滴管、___。
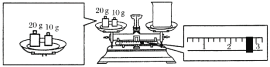
(2)某同学欲称量氢氧化钠的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图所示。烧杯的实际质量为___g,要完成本实验该同学应称出__g氢氧化钠。
(3)如图是该同学转移溶液的示意图,图中有两处错误,请写出:
①____;
②____。
(4)在配制过程中,其他操作都是正确的,下列操作会引起浓度偏高的是__(填字母)。
A.所用氢氧化钠已经潮解
B.溶液未冷却至室温就注入容量瓶中定容
C.在配置过程中未洗涤烧杯和玻璃棒
D.定容时,俯视容量瓶刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种蓝色晶体[可表示为MxFey(CN)6],经X射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上。其晶体中阴离子的最小结构单元如下图所示。下列说法正确的是( )。
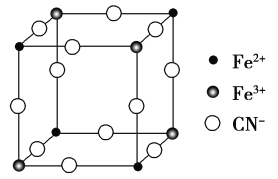
A. 该晶体属于离子晶体,M呈+1价
B. 该晶体属于离子晶体,M呈+2价
C. 该晶体属于分子晶体,化学式为MFe2(CN)6
D. 晶体中与每个Fe3+距离最近且等距离的CN-有12个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com