

 .
. 分析 (1)丙烯含有碳碳双键,可发生加聚反应生成聚丙烯;
(2)乙醇与浓硫酸混合加热到170℃发生消去反应生成乙烯;
(3)乙醇在Cu做催化剂加热时与氧气反应,被氧化生成乙醛和水;
(4)醛类可以发生银镜反应生成羧酸铵、金属单质银以及氨气;
(5)甲醛与新制氢氧化铜悬浊液在加热条件下发生反应生成二氧化碳、氧化亚铜和水;
(6)2-溴丙烷与氢氧化钠水溶液共热,发生水解反应生成2-丙醇;
解答 解:(1)丙烯含有碳碳双键,可发生加聚反应生成聚丙烯,反应的方程式为 ,故答案为:
,故答案为: ;
;
(2)乙醇与浓硫酸混合加热到170℃发生消去反应生成乙烯,反应的化学方程式为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(3)乙醇在Cu做催化剂加热时与氧气反应,被氧化生成乙醛和水,方程式为2CH3CH2OH+O2$→_{△}^{铜}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{铜}$2CH3CHO+2H2O;
(4)丙醛中醛基被银氨试剂氧化,发生银镜反应生成丙酸铵、金属单质银以及氨气,反应的化学方程式为:CH3CH2CHO+2Ag(NH3)2OH$\stackrel{水浴}{→}$CH3CH2COONH4+2Ag↓+3NH3+H2O,
故答案为:CH3CH2CHO+2Ag(NH3)2OH$\stackrel{水浴}{→}$CH3CH2COONH4+2Ag↓+3NH3+H2O;
(5)甲醛与新制氢氧化铜悬浊液在加热条件下发生反应生成二氧化碳、氧化亚铜和水,方程式:HCHO+4Cu(OH)2$\stackrel{△}{→}$CO2↑+2Cu2O↓+5H2O;
故答案为:HCHO+4Cu(OH)2$\stackrel{△}{→}$CO2↑+2Cu2O↓+5H2O;
(6)2-溴丙烷与氢氧化钠水溶液共热,发生水解反应生成2-丙醇,反应为 ,
,
故答案为: ;
;
点评 本题考查有机化学反应方程式的书写,为高频考点,把握有机物的结构与性质、反应类型与反应条件为解答的关键,注重基础知识的夯实,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
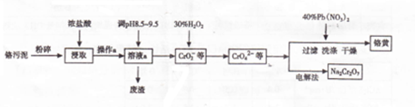
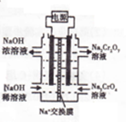
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在稀氨水中通入过量CO2:NH3•H2O+CO2═NH4++HCO3- | |
| B. | 向(NH4)2SO4溶液中加入适量Ba(OH)2:Ba2++SO42-=BaSO4↓ | |
| C. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| D. | 氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42-═CaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 半径:Y2->Z->X+>W3+ | B. | 还原性:Y2->Z- | ||
| C. | 氧化性:W3+>X+ | D. | 质子数:c>d>b>a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28 g C2H4所含共用电子对数目为4NA | |
| B. | 1 L 0.1 mol•L-1乙酸溶液中H+数为0.1NA | |
| C. | 1 mol甲烷分子所含质子数为10NA | |
| D. | 标准状况下,22.4 L乙醇的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
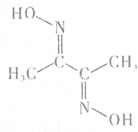 铁、钴、镍等金属及其化合物在工业上有重要用途.请回答:
铁、钴、镍等金属及其化合物在工业上有重要用途.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a+2b-c | B. | a+b-2c | C. | 2a+2b-c | D. | a+2b-2c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
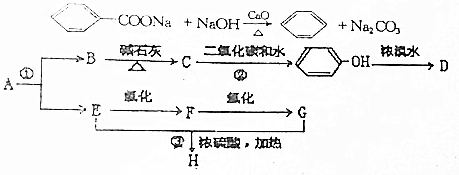
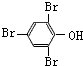 ;化合物H的名称甲酸甲酯.
;化合物H的名称甲酸甲酯.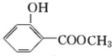 ,
,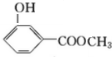 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com