
| A、HNO3 |
| B、HCl |
| C、NaOH |
| D、Cl2 |


科目:高中化学 来源: 题型:
| A、溶液的浓度变为0.08mol/L |
| B、阳极上产生112mLO2(标准状况) |
| C、转移的电子数是1.204×1022个 |
| D、反应中有0.01mol的Ag被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、18gH2O中所含电子数与NA个 NH4+所含电子数相同 |
| B、1 mol Na2O2固体中含离子总数为3NA |
| C、13g锌粒加入浓硫酸,反应后锌粒无剩余,得到标况下气体4.48L |
| D、将饱和食盐水加热蒸发少量水,冷却至原温度,溶液的质量分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
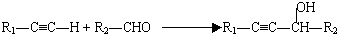 (R代表烃基,下同.)
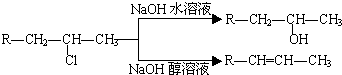
(R代表烃基,下同.)| Pd,BaSO4 |
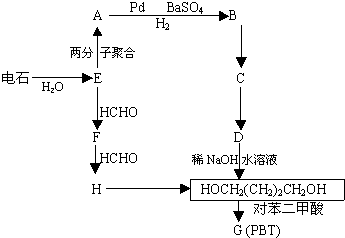
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④ | B、①③⑤ |
| C、②④⑥ | D、②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
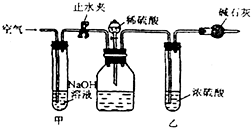
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com