
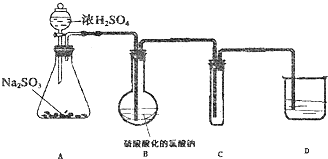
分析 (1)根据装置图可知,装置A适用于液、液不加热或液、固不加热的反应装置,据此判断;
(2)根据装置图可知,检验装置的气密性的方法为,关闭分液漏斗的活塞,将导气管插入盛有水的烧杯中,微热锥形瓶,若导管未端产生气泡,并在停止微热后,倒吸形成一段水柱且达到最高点后高度不变,说明装置不漏气;
(3)二氧化硫与氯酸钠的反应需在75~90℃进行,所以要用温度计测量反应液的温度,B中用二氧化硫还原氯酸钠(NaClO3)产生二氧化氯,根据电荷守恒和元素守恒书写反应的离子方程式;
(4)装置C是用来收集ClO2,ClO2熔点为-59℃,沸点为11℃,易挥发,据此答题;
(5)因为NaClO2饱和溶液在较低温度时析出晶体NaClO2•3H2O,在较高温度时析出晶体 NaClO2,而NaClO3在高温时溶解度很大,所以从该混合溶液中获得晶体NaClO2在蒸发浓缩结晶后要趁热过滤,这样才能得到晶体NaClO2;
(6)根据实验原理,用淀粉做指示剂时,用Na2S2O3溶液滴定反应中生成的I2,实验终点时溶液的蓝色褪色,根据电子得失守恒可知2ClO2~5I2,结合反应2S2O32-+I2═S4O62-+2I-,由Na2S2O3的物质的量可计算出样品中ClO2的质量,进而确定水样中ClO2的浓度,若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则读出的Na2S2O3溶液的体积偏大,据此分析.
解答 解:(1)根据装置图可知,装置A适用于液、液不加热或液、固不加热的反应装置,
a.用过氧化氢与二氧化锰制氧气,是固、液不加热的反应,故选;
b.用铜与浓硫酸制二氧化硫,反应需要加热,故不选;
c.用硫化亚铁与稀硫酸制硫化氢,是固、液不加热的反应,故选;
d.只用浓氨水制氨气,需要加热,故不选,
故选ac;
(2)根据装置图可知,检验装置的气密性的方法为,关闭分液漏斗的活塞,将导气管插入盛有水的烧杯中,微热锥形瓶,若导管未端产生气泡,并在停止微热后,倒吸形成一段水柱且达到最高点后高度不变,说明装置不漏气,
故答案为:关闭分液漏斗活塞;倒吸形成一段水柱且达到最高点后高度不变;
(3)二氧化硫与氯酸钠的反应需在75~90℃进行,所以要用温度计测量反应液的温度,B中用二氧化硫还原氯酸钠(NaClO3)产生二氧化氯,反应的离子方程式为2ClO3-+SO2=2ClO2+SO42-,
故答案为:温度计;2ClO3-+SO2=2ClO2+SO42-;
(4)装置C是用来收集ClO2,ClO2熔点为-59℃,沸点为11℃,易挥发,所以为了使ClO2充分冷凝,减少挥发,要用冰水浴,
故答案为:使ClO2充分冷凝,减少挥发;
(5)因为NaClO2饱和溶液在较低温度时析出晶体NaClO2•3H2O,在较高温度时析出晶体 NaClO2,而NaClO3在高温时溶解度很大,所以从该混合溶液中获得晶体NaClO2在蒸发浓缩结晶后要趁热过滤,这样才能得到晶体NaClO2,
故答案为:趁热过滤;
(6)根据实验原理,用淀粉做指示剂时,用Na2S2O3溶液滴定反应中生成的I2,实验终点时的现象为,溶液的蓝色消失,半分钟内不变色,在滴定实验中,操作Ⅱ时消耗了1.0×10-3 mol•L-1的Na2S2O3溶液10mL,其物质的量为1.0×10-3 mol/L×0.01L,
ClO2 ~I-~S2O32-
1 1
1.0×10-5mol 1.0×10-3 mol/L×0.01L
m(ClO2)=n(ClO2)×M(ClO2)=1.0×10-5mol×67.5×103mg•mol-1=0.675mg,
由于水样的体积为1.0L,所以 ClO2 的浓度为$\frac{0.675mg}{1L}$=0.675 mg•L-1,若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则读出的Na2S2O3溶液的体积偏大,则测定结果偏高,
故答案为:蓝色消失,半分钟内不变色;0.675;偏高.
点评 题考查物质含量的测定实验,为高频考点,把握发生的氧化还原反应、关系式法的计算为解答的关键,侧重分析与计算能力的综合考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 只有(1)(2) | B. | 只有(1)(2)(3) | C. | 只有(4)(5) | D. | 全不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焓减小的反应通常是自发的,能够自发进行的反应都是焓减小的反应 | |
| B. | 熵增加的反应通常是自发的,能够自发进行的反应都是熵增加的反应 | |
| C. | 常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 | |
| D. | △H<0且△S<0的反应一定能自发发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
| 易溶于水,微溶于乙醇、两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |

| 实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 体系pH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
| 产率/% | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 | 56.68 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
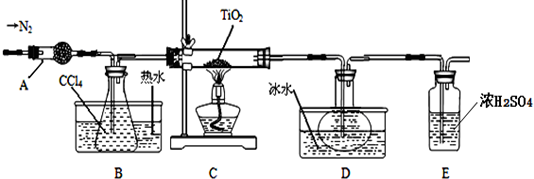
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
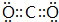 ;C2B2所含化学键为离子键、共价键.
;C2B2所含化学键为离子键、共价键.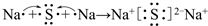 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NO2═O2+2NO;△H=+116.2kJ/mol(燃烧热) | |
| B. | 2S(s)+2O2(g)═2SO2(g);△H=-269.8kJ/mol(燃烧热) | |
| C. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-57.3kJ/mol(中和热) | |
| D. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 1:2 | C. | 2:3 | D. | 2:17 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.3 g 金属钠所含钠原子数目为0.2 N A | |
| B. | 2 g 氢气所含原子数目为2 N A | |
| C. | 17 g NH 3所含的分子数为2 N A | |
| D. | N A个O 2和 N A个H 2的所含原子数目比等于16:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com