
【题目】根据碘与氢气反应的热化学方程式
① I2(g)+ H2(g)![]() 2HI(g) ΔH=-9.48 kJ/mol
2HI(g) ΔH=-9.48 kJ/mol
② I2(s)+ H2(g)![]() 2HI(g) ΔH=+26.48 kJ/mol
2HI(g) ΔH=+26.48 kJ/mol
下列判断正确的是
A.254g I2(g)中通入2gH2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应②的反应物总能量比反应①的反应物总能量低
D.反应①的产物比反应②的产物稳定
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】铁、铜及其化合物在日常生产、生活中有着广泛的应用。请回答下列问题:
(1)铁在元素周期表中的位置是____,基态铁原子的核外电子排布式为_________。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于________晶体(填晶体类型)。CO2在高温高压下所形成的晶体其晶胞如下图所示。则该晶体的类型属于_________晶体(填晶体类型)。

(3)铜晶体中铜原子的堆积方式如下图所示。其中铜原子的配位数为_______。

(4)CuCl2和CuCl是铜的两种常见的氯化物。
①下图表示的是________(填“CuCl2”或“CuCl”)的晶胞。

②原子坐标参数表示晶胞内部各原子的相对位置。上图中各原子坐标参数A为(0,0,0);B为(0,1,1);C为(1,1,0);则D原子的坐标参数为_______。
③图示晶胞中C、D两原子核间距为298pm,阿伏加德罗常数的值为NA,则该晶体密度为_____g·cm-3。(列出计算式即可)相对原子质量:Cu 64 Cl 35.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁溶液和过量碳酸氢铵溶液混合,过滤、洗涤、干燥得到碳酸亚铁,在空气中灼烧碳酸亚铁得到铁的氧化物M。利用滴定法测定M的化学式,其步骤如下:
①称取3.92g样品M溶于足量盐酸,并配成100mL溶液A。
②取20.00mL溶液A于锥形瓶中,滴加KSCN溶液,溶液变红色;再滴加双氧水至红色刚好褪去,同时产生气泡。
③待气泡消失后,用1.0000 mol·L-1 KI标准溶液滴定锥形瓶中的Fe3+,达到滴定终点时消耗KI标准溶液10.00 mL。
(1)实验中必需的定量仪器有量筒、电子天平、____________和____________。
(2)在滴定之前必须进行的操作包括用标准KI溶液润洗滴定管、__________、___________。
(3)步骤②中“气泡”有多种可能,完成下列猜想:
①提出假设:
假设1:气泡可能是SCN-的反应产物N2、CO2、SO2或N2,CO2。
假设2:气泡可能是H2O2的反应产物____________,理由___________。
②设计实验验证假设1:
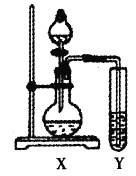
试管Y中的试剂是_______。
(4)根据上述实验,写出硫酸亚铁溶液和过量碳酸氢铵溶液混合制备碳酸亚铁的离子方程式_____。
(5)根据数据计算,M的化学式为_______。
(6)根据上述实验结果,写出碳酸亚铁在空气中灼烧的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.H2的热值(单位质量的燃料完全燃烧时所放出的热量,叫做燃料的热值)为142.9kJg-1,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)=2H2O(l) △H=-285.8kJmol-1
B.反应A(g)=2B(g),若正反应的活化能为EakJmol-1,逆反应的活化能为EbkJmol-1,则△H=(Ea-Eb)kJmol-1
C.能自发进行的化学反应,一定是△H<0、△S>0
D.增大反应物浓度,可增大单位体积内活化分子百分数,从而增加有效碰撞的次数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A、B、C三个装置中的烧杯分别盛有足量的CuSO4溶液。
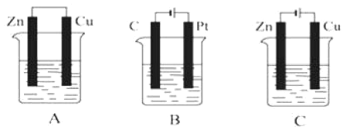
(1)A、B、C三个装置中属于原电池的是___(填字母,下同),属于电解池的是___。
(2)A池中Cu电极上发生的是___(填“氧化”或“还原”)反应。
(3)B池中C是___极,Pt极发生的反应的电极反应式为___。
(4)C池反应过程中,CuSO4溶液的物质的量浓度___(填“变大”“变小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下的密闭容器中:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-905.9kJ·mol-1,下列叙述正确的是( )
4NO(g)+6H2O(g) ΔH=-905.9kJ·mol-1,下列叙述正确的是( )
A.4molNH3和5molO2反应,达到平衡时放出热量为905.9kJ
B.平衡时v正(O2)=![]() v逆(NO)
v逆(NO)
C.平衡后降低压强,混合气体平均摩尔质量增大
D.平衡后升高温度,混合气体中NO含量降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列设计方案都正确的是( )
A.制备绿矾(FeSO47H2O):将FeSO4溶液在空气中低温蒸发即得绿矾
B.将0.1000mol/L的KMnO4溶液装在碱式滴定管中滴定未知浓度的过氧化氢溶液,读出消耗的高锰酸钾的体积即可求出过氧化氢的浓度
C.探究催化剂对H2O2分解速率影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象
D.用一定浓度的盐酸标准液滴定未知浓度的氨水,可选用酚酞作指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g),下列叙述错误的是
CH3CH2OH(g)+3H2O(g),下列叙述错误的是
A.使用Cu-Zn-Fe催化剂可大大提高生产效率
B.反应需在300℃进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知在氨水中存在下列平衡:NH3·H2O![]() NH4++OH-。
NH4++OH-。
①向氨水中加入NH4Cl固体时,平衡__移动(填“向右”或“向左”),c(OH-)__(填“增大”或“减小”)。
②向氨水中加水稀释时,平衡___移动(填“向右”或“向左”)。
(2)FeCl3净水的原理是(用离子方程式表示)__,将AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是__(写化学式)。
(3)已知草酸是二元弱酸,常温下测得0.1mol/L的KHC2O4的pH为4.8,则此KHC2O4溶液中c(C2O42-)__c(H2C2O4)(填“大于”或“小于”或“等于”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com