


科目:高中化学 来源: 题型:
| A、2.4g 镁作还原剂时失去电子数是0.1×6.02×1023 |
| B、标准状况下,22.4L 氮气中含有的共价键数是6.02×1023 |
| C、标准状况下,5.6 L的甲醛所含的电子数是4×6.02×1023 |
| D、100mL 1mol/L氨水溶液中,铵根离子的个数0.1×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
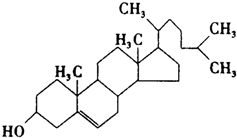
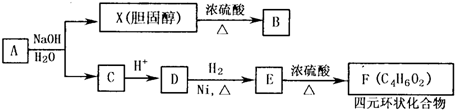
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 Fenton法常用于处理含难降解有机物的工业废水,通常先调节好Fe2+等离子的浓度,再向废水中加入H2O2,所产生的羟基自由基(Fe2++H2O2→Fe3++OH-+HO?)能氧化降解污染物.如:降解废水中丙二醇(分子式C3H8O2)的反应为:C3H8O2+8H2O2
Fenton法常用于处理含难降解有机物的工业废水,通常先调节好Fe2+等离子的浓度,再向废水中加入H2O2,所产生的羟基自由基(Fe2++H2O2→Fe3++OH-+HO?)能氧化降解污染物.如:降解废水中丙二醇(分子式C3H8O2)的反应为:C3H8O2+8H2O2| FeSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某纯碱样品中含有少量氯化钠杂质,为了测定此样品纯度,甲同学设计了如图所示装置和实验方案.实验步骤如下:
某纯碱样品中含有少量氯化钠杂质,为了测定此样品纯度,甲同学设计了如图所示装置和实验方案.实验步骤如下:| 序号 | 改进意见 | 缺少时的影响 |
| ① | ||
| ② | ||
| ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁粉投醋酸溶液中:Fe+2H+=Fe2++H2↑ |
| B、Cl2溶于水:Cl2+H2O=2H++Cl-+ClO- |
| C、氢氧化钡溶液中滴加硫酸氢钠溶液至恰好为中性:Ba2++SO42-+2OH-+2H+=BaSO4↓+2H2O |
| D、向饱和澄清石灰水中加入纯碱溶液:Ca(OH)2+CO32-=CaCO3↓+2OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com