
£Ø8·Ö£©
¢ń”¢AŗĶB·“Ӧɜ³ÉC£¬¼Ł¶Ø·“Ó¦øÕæŖŹ¼Ö»ÓŠA”¢B£¬ĖüĆĒµÄĘšŹ¼ÅØ¶Č¾łĪŖ1mol/L”£·“Ó¦½ųŠŠ2minŗóAµÄÅضČĪŖ0.8mol/L£¬BµÄÅضČĪŖ0.6mol/L£¬CµÄÅضČĪŖ0.6mol/L”£ŌņŌŚÕā2minÄŚ·“Ó¦µÄĘ½¾łĖŁĀŹVA =_______mol/(L”¤ min)£¬VB=________mol/(L”¤ min)£¬VC =________ mol/(L”¤ min)”£øĆ·“Ó¦µÄ»Æѧ·“Ó¦·½³ĢŹ½ĪŖ:___________________________”£

¢ņ”¢ ijĪĀ¶ČŹ±£¬ŌŚŅ»øö2LµÄĆܱÕČŻĘ÷ÖŠ£¬X”¢Y”¢ZČżÖÖĪļÖŹµÄĪļÖŹµÄĮæĖꏱ¼äµÄ±ä»ÆĒśĻßČēÉĻĶ¼ĖłŹ¾”£øł¾ŻĶ¼ÖŠŹż¾Ż£¬ŹŌĢīŠ“ĻĀĮŠæÕ°×£ŗ
£Ø1£©øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ £»
£Ø2£©“ÓæŖŹ¼ÖĮ2min£¬ZµÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ mol/(L”¤ min)£»
¢ń”¢0.1£Ø1·Ö£© 0.2£Ø1·Ö£© 0.3 £Ø1·Ö£© A+2B=3C£Ø2·Ö£©
¢ņ”¢Y
+ 3X  2Z £Ø2·Ö£© 0.05 £Ø1·Ö£©
2Z £Ø2·Ö£© 0.05 £Ø1·Ö£©
”¾½āĪö”æ¢ń”¢ A + B ”śC
C0 1 1 0
”÷C 0.2 0.4 0.6
C£Ø2min£©0.8 0.6 0.6
ŌņVA=£Ø0.2 mol/L£©/2min=0.1 mol/(L”¤ min)£¬VB =£Ø0.4 mol/L£©/2min=0.2 mol/(L”¤ min)£¬
VC =£Ø0.3 mol/L£©/2min=0.3 mol/(L”¤ min)£»
ŌņVA£ŗVB£ŗVC =1:2:3£¬ŌŚĶ¬Ņ»øö·“Ó¦ÖŠ£¬ĖŁĀŹ±Č=ĻµŹż±Č£¬¹Ź·“Ó¦µÄ»Æѧ·“Ó¦·½³ĢŹ½ĪŖA+2B=3C£»
¢ņ”¢·ÖĪöĶ¼Ļń£¬µĆ£ŗĖę×ÅŹ±¼äµÄŃÓ³¤£¬¼“Ėę×Å·“Ó¦µÄ½ųŠŠ£¬n(X)”¢n(Y)¼õŠ”£¬ŌņX”¢YŹĒ·“Ó¦Īļ£¬n(z)Ōö“ó£¬ŌņZĪŖÉś³ÉĪļ£»ŌŁæ“¶ØĮæ¹ŲĻµ£¬X”¢Y”¢ZŌŚ2minÖŠĪļÖŹµÄĮæµÄ±ä»Æ£Ø”÷n£©ŅĄ“ĪĪŖ0.3 mol”¢0.1 mol”¢0.2 mol£¬ČżÕߵĔ÷nÖ®±Č=·½³ĢŹ½ÖŠČżÕßµÄĻµŹż±Č£¬ĒŅ2minŗóČżÕßµÄĪļÖŹµÄĮæ¾ł²»ŌŁ±ä»Æ£¬ĖµĆ÷“ļµ½ĮĖĘ½ŗāĢ¬£¬¼“ÕāŹĒŅ»øöæÉÄę·“Ó¦£¬¹Ź·½³ĢŹ½3X +Y 2Z£»
2Z£»
VZ=£Ø0.2 mol/2L£©/2min=0.05 mol/(L”¤ min)£»


 ¾µäĆܾķĻµĮŠ“š°ø
¾µäĆܾķĻµĮŠ“š°ø ½šÅĘæĪĢĆĮ·ĻµĮŠ“š°ø
½šÅĘæĪĢĆĮ·ĻµĮŠ“š°ø ČżŠĀæģ³µ½šÅĘÖÜÖÜĮ·ĻµĮŠ“š°ø
ČżŠĀæģ³µ½šÅĘÖÜÖÜĮ·ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
 £Ø¢ń£©Ķس£ĒéæöĻĀ£¬Ī¢Į£AŗĶBĪŖ·Ö×Ó£¬CŗĶEĪŖŃōĄė×Ó£¬DĪŖŅõĄė×Ó£¬ĖüĆĒ¶¼ŗ¬ÓŠ10øöµē×Ó£»BČÜÓŚAŗóĖłµĆµÄĪļÖŹæɵēĄė³öCŗĶD£»A”¢B”¢EČżÖÖĪ¢Į£·“Ó¦ŗóæɵĆCŗĶŅ»ÖÖ°×É«³Įµķ£®Ēė»Ų“š£ŗ
£Ø¢ń£©Ķس£ĒéæöĻĀ£¬Ī¢Į£AŗĶBĪŖ·Ö×Ó£¬CŗĶEĪŖŃōĄė×Ó£¬DĪŖŅõĄė×Ó£¬ĖüĆĒ¶¼ŗ¬ÓŠ10øöµē×Ó£»BČÜÓŚAŗóĖłµĆµÄĪļÖŹæɵēĄė³öCŗĶD£»A”¢B”¢EČżÖÖĪ¢Į£·“Ó¦ŗóæɵĆCŗĶŅ»ÖÖ°×É«³Įµķ£®Ēė»Ų“š£ŗ
| ||
| ||
| ||
| ||
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
 ŅŃÖŖA”¢B”¢C”¢DĪŖĘųĢ壬E”¢FĪŖ¹ĢĢ壬GŹĒĀČ»ÆøĘ£¬ĖüĆĒÖ®¼äµÄ×Ŗ»»¹ŲĻµČēĶ¼ĖłŹ¾£ŗ?
ŅŃÖŖA”¢B”¢C”¢DĪŖĘųĢ壬E”¢FĪŖ¹ĢĢ壬GŹĒĀČ»ÆøĘ£¬ĖüĆĒÖ®¼äµÄ×Ŗ»»¹ŲĻµČēĶ¼ĖłŹ¾£ŗ?
| ||
| ||
| ||
| ||
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
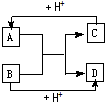 ŅŃÖŖA”¢B”¢C”¢D·Ö±šŹĒ֊ѧ»Æѧ֊³£¼ūµÄĖÄÖÖ²»Ķ¬Į£×Ó£¬ĖüĆĒÖ®¼äÓŠČēĻĀĶ¼ĖłŹ¾·“Ó¦¹ŲĻµ£®
ŅŃÖŖA”¢B”¢C”¢D·Ö±šŹĒ֊ѧ»Æѧ֊³£¼ūµÄĖÄÖÖ²»Ķ¬Į£×Ó£¬ĖüĆĒÖ®¼äÓŠČēĻĀĶ¼ĖłŹ¾·“Ó¦¹ŲĻµ£® »ņ
»ņ
 »ņ
»ņ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com