解:(1)当加入NaOH溶液的体积为35ml时,n(NaOH)=0.035L×10mol/L=0.35mol,
此时沉淀的质量达到最大值,则此时溶液的溶质只有Na
2SO
4,
根据Na元素守恒有n(Na
2SO
4)=

n(NaOH)=

×0.35mol=0.175mol,
根据硫酸根守恒,则有:n(H
2SO
4)=0.175mol,
所以原硫酸溶液中c(H
2SO
4)=

=1.75mol/L,
答:稀硫酸溶液的物质的量浓度为1.75mol/L;
(2)从35mL~45mL加入的10mL氢氧化钠完全溶解氢氧化铝,该阶段消耗的n(NaOH)=0.01L×10mol/L=0.1mol,根据方程式Al(OH)
3+NaOH=NaAlO
2+2H
2O可知,n[Al(OH)
3]=0.1mol,故溶液中n(Al
3+)=0.1mol,铝离子完全沉淀消失氢氧化钠为0.1mol×3=0.3mol,铁离子、铝离子完全消耗的氢氧化钠溶液的体积为35mL-2.3mL=32.7mL,故该阶段消耗n(NaOH)=0.0327L×10mol/L=0.327mol,故铁离子完全沉淀消耗的氢氧化钠为0.327mol-0.3mol=0.027mol,故n(Fe
3+)=

=0.009mol,故m(Fe
2O
3)=0.009mol×

×160g/mol=0.72g,故Fe
2O
3的质量分数为

×100%=12%
答:铝土矿中Fe
2O
3的质量分数为12%.
分析:(1)加入35mL氢氧化钠溶液时,沉淀量最大,此时溶液中溶质为硫酸钠,根据钠离子守恒计算硫酸钠的物质的量,再根据硫酸根守恒计算原硫酸溶液中n(H
2SO
4),再根据c=

计算;
由图可知,加入35mL氢氧化钠溶液时,沉淀量最大,NaOH溶液的体积超过35mL时,过量的氢氧化钠与氢氧化铝反应:Al(OH)
3+NaOH=NaAlO
2+2H
2O;
(2)从35mL~45mL加入的10mL氢氧化钠完全溶解氢氧化铝,根据n=cV计算该阶段消耗的n(NaOH),再根据方程式计算氢氧化铝的物质的量,利用铝元素守恒计算溶液中n(Al
3+),进而计算铝离子完全沉淀消耗的氢氧化钠的物质的量,根据n=cV计算铁离子、铝离子完全消耗的n(NaOH),进而计算n(Fe
3+),利用铁元素守恒计算n(Fe
2O
3),根据m=nM计算氧化铁的质量,根据质量分数定义计算.
点评:本题考查混合物的有关计算,难度中等,清楚图象中各阶段发生的反应是关键,注意根据守恒的计算,(1)中注意利用反应判断沉淀最大值时,溶液中的溶质,再利用守恒计算,可以简化计算过程.

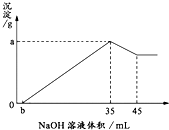 取6g铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如图所示.试求:
取6g铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如图所示.试求: n(NaOH)=
n(NaOH)= ×0.35mol=0.175mol,
×0.35mol=0.175mol, =1.75mol/L,
=1.75mol/L, =0.009mol,故m(Fe2O3)=0.009mol×
=0.009mol,故m(Fe2O3)=0.009mol× ×160g/mol=0.72g,故Fe2O3的质量分数为
×160g/mol=0.72g,故Fe2O3的质量分数为 ×100%=12%
×100%=12% 计算;
计算;

 准确称取6g铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mL 稀H2SO4溶液的烧杯中,充分反应后过滤去掉沉淀,向滤液中加入10mol/L的NaOH溶液,产生沉淀的质量和加入的NaOH溶液的体积(mL)如图所示.试回答下列问题:
准确称取6g铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mL 稀H2SO4溶液的烧杯中,充分反应后过滤去掉沉淀,向滤液中加入10mol/L的NaOH溶液,产生沉淀的质量和加入的NaOH溶液的体积(mL)如图所示.试回答下列问题: