
(15分)
(1) A的名称为____
(2) G中含氧官能团名称为____
(3) D的分子中含有____种不同化学环境的氢原子
(4) E与新制的氢氧化铜反应的化学方程式为____
(5)写出符合下列条件的A的所有同分异构体的结构简式:____
A.分子中有6个碳原子在一条直线上:b.分子中含--OH
(6)正戊醇可用作香料、橡胶促进剂等,写出以乙醇为原料制备 的合成路线流
的合成路线流
程图(无机试剂任用)。合成路线流程示意图示例如下:

(15分)
(1)3—甲基苯酚(或间甲基苯酚)(2分) (2)酯基(1分)
(3)2(2分)
(4)(CH3)2CHCH2CHO+2Cu(OH)2+NaOH (CH3)2CHCH2COONa+Cu2O↓+3H2O
(CH3)2CHCH2COONa+Cu2O↓+3H2O
【解析】
试题分析:A能与FeCl3溶液发生显色反应,说明A含有酚羟基,对比G的结构,可得A的结构简式为:  根据信息③,A与CH3CH=CH2在AlCl3条件下发生烃基化反应,得到B为:
根据信息③,A与CH3CH=CH2在AlCl3条件下发生烃基化反应,得到B为: 根据信息②和G的结构可知D为:(CH3)2C=CH2,D与CO、H2在PbCl2条件下生成的E为:(CH3)2CHCH2CHO,E被H2O2氧化为羧酸,F为:(CH3)2CH CH2COOH。
根据信息②和G的结构可知D为:(CH3)2C=CH2,D与CO、H2在PbCl2条件下生成的E为:(CH3)2CHCH2CHO,E被H2O2氧化为羧酸,F为:(CH3)2CH CH2COOH。
(1)A的结构简式为:  ,名称为:3—甲基苯酚(或间甲基苯酚)。
,名称为:3—甲基苯酚(或间甲基苯酚)。
(2)根据G的结构简式可知G中含氧官能团名称为酯基。
(3)D的结构简式为:(CH3)2C=CH2,所以D的分子中含有2种不同化学环境的氢原子。
(4)E为:(CH3)2CHCH2CHO,含有醛基,所以新制的氢氧化铜氧化,化学方程式为:
(CH3)2CHCH2CHO+2Cu(OH)2+NaOH (CH3)2CHCH2COONa+Cu2O↓+3H2O
(CH3)2CHCH2COONa+Cu2O↓+3H2O
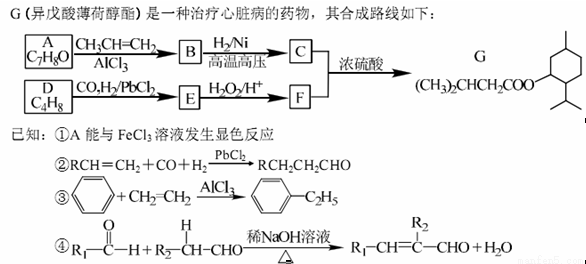
(5)根据a.分子中有6个碳原子在一条直线上:b.分子中含--OH,可知a分子含有两个碳碳三键,可能有三种结构,①CH3—C≡C—C≡C—CH2—CH2OH、②CH3—C≡C—C≡C—C(OH)—CH3、 ③CH3—CH2—C≡C—C≡C—CH2OH
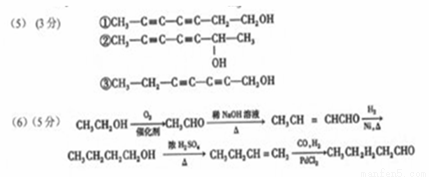
(6)CH3CH2OH在催化剂条件下与O2反应生成CH3CHO,根据信息④,CH3CHO发生羟醛缩合转化为:CH3CH=CHCHO,与H2加成转化为CH3CH2CH2CH2OH,发生消去反应生成CH3CH2CH=CH2,根据信息②,与CO、H2在PbCl2条件下生成CH3CH2CH2CH2CHO,所以合成路线流程示意图为:

考点:本题考查有机合成的分析与推断、同分异构体、化学方程式的书写。


科目:高中化学 来源:2013-2014湖南师大附中第二学期期中考试高一化学试卷(解析版) 题型:填空题
(11分)在第3周期中,置换酸中氢的能力最强的元素的元素符号为 ,化学性质最稳定的元素符号是 ,最高价氧化物的水化物的酸性最强的化合物的化学式是 ,最高价氧化物的水化物的碱性最强的化合物的化学式是 ,显两性的氢氧化物的化学式是 ,该两性氢氧化物与盐酸、氢氧钠溶液分别反应的离子方程式为 、 ,原子半径最大的金属元素的名称是 ,离子半径最小的离子结构示意图是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省高三5月模拟考试理综化学试卷(解析版) 题型:填空题
(14分)(1)NO2有较强的氧化性,能将SO2氧化生成SO3,本身被还原为NO,已知下列两反应过程中能量变化如图所示:

则NO2氧化SO2的热化学方程式为_________________________________。
(2)在2L密闭容器中放入1mol氨气,在一定温度进行如下反应:2NH3(g) N2(g)+3H2(g),
N2(g)+3H2(g),
反应时间(t)与容器内气体总压强(p)的数据见下表
时间t/min | 0 | 1 | 2 | 3 | 4 | 5 |
总压强p 100 kPa | 5 | 5.6 | 6.4 | 6.8 | 7 | 7 |
则平衡时氨气的转化率为___________。
(3)25℃,某二元弱酸H2A与NaOH溶液反应可生成NaHA、Na2A,溶液中含A各微粒的分布分数(平衡时某含A微粒的浓度占各含A微粒浓度之和的分数)随溶液变化的情况如下图所示:
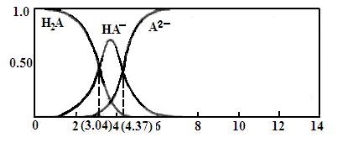
已知:103.04=1.1×103,104.37=2.3×104 25℃,Ka1(H2CO3)= 4.4×10-7 Ka2(H2CO3) = 4.7×10-11
①若向0.1NaHAmol·L-1溶液中加入少量NaOH溶液,c(A2-)/c(HA-)的值 (填“增大”、“减小”或“不变”,下同),c(H+)/c(OH-) 的值 。
②若向0.1NaHAmol·L-1溶液中加入氨水至溶液呈中性,则c(H2A)+c(NH4+) c(A2-) (填“大于”、“小于”或“等于”)。
③计算HA-二级电离平衡常数Ka2= 。
④将过量H2A加入Na2CO3溶液中反应的离子方程式为: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省高一下学期期中联考化学试卷(解析版) 题型:选择题
关于下列图示的说法正确的是


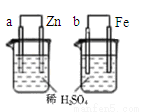

A.图①表示石墨转变为金刚石是吸热反应
B.图②所示实验可比较非金属性强弱:氯﹥碳﹥硅
C.图③吸收NH3并防倒吸
D.图④两装置中金属电极a、b都有气体产生,可判断金属活动性:a﹤b
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省高一下学期期中联考化学试卷(解析版) 题型:选择题
对于反应A(g)+3B(g)  2C(g),下列各数据表示同一反应速率是
2C(g),下列各数据表示同一反应速率是
①v(A)=0. 10 mol/(L? min) ②v(B)=0. 20 mol/(L? min)
③v(B)=0.30mol/(L?min) ④v(C)=1.00mol/(L?min)
A.①② B.①③ C.③④ D.②④
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省武汉市高三四月调考理综化学试卷(解析版) 题型:简答题
(13分)某种电池的正极材料,可通过下列方法制得:
①称取一定量的固体铁氧体磁性材料溶于过量盐酸,接着先后加入双氧水和氢氧化钠溶液,静置24 h,过滤
②将沉淀加入反应瓶中,加入过量的氢氟酸溶液,80'c恒温加热24 ha
③蒸发多余氢氟酸和水,得淡红色FeF3凝胶
④在干燥箱中,以1000C预处理6 h,最后掺入铁氧体磁性材料混合研磨制得正极材料
(1)加入双氧水的作用是___(用离子方程式表示)
(2)步骤②的反应瓶材质可能是___(填序号)
A.玻璃 B.陶瓷 C.聚四氟乙烯
(3)加氢氟酸反生反应的化学方程式为____
(4)从安全的角度考虑,在实验室里制三氟化铁时应在____中进行
(5)三氟化铁与Li在固体电解质铁氧体中发生置换反应,产生的电流可供电脑使用,该电池反
应的化学方程式为____
(6)取上述铁氧体样品溶于足量盐酸,在通入标准状况下672 mL C12, Fe2+恰好被完全氧化成
Fe3十,然后把溶液蒸干,灼烧至恒重得9.6 g固体,则该铁氧体的化学式为____。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省武汉市高三四月调考理综化学试卷(解析版) 题型:选择题
下列说法不正确的是:
A.通过煤的干馏可获得苯、甲苯等芳香烃
B.在海轮外壳装上锌块,可减缓船体的腐蚀速率
C.电渗析法、离子交换法中,只有后者可以应用于海水的淡化
D.我国城市推广使用清洁燃料是压缩天然气类和液化石油气类
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省武汉外国语学校高一下学期期中考试化学试卷(解析版) 题型:选择题
某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素
A.在自然界中只以化合态的形式存在B.单质常用作半导体材料和光导纤维
C.最高价氧化物不与酸反应D.气态氢化物比甲烷稳定
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省四校下学期期中考试高一化学试卷(解析版) 题型:填空题
(9分)元素周期律是指导我们学习元素及其化合物知识的重要工具。已知氧族元素(不含Po)的部分知识如下表所示,
元素 | 8O | 16S | 34Se | 52Te |
单质熔点(℃) | -218.4 | 113 |
| 450 |
单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
元素主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 |
|
原子半径 | 逐渐增大 | |||
单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
请总结表中知识规律,并依据元素周期律回答下列问题:
(1)单质硒的熔点范围可能是________________。
(2)元素碲的主要化合价可能有________________。
(3)硫、硒、碲的氢化物水溶液的酸性由强至弱的顺序是________________ (用化学式表示)。
(4)氢硒酸有较强的__________(填“氧化性”或“还原性”),因此露置在空气中长期保存易变质,其可能发生反应的化学方程式为_________________________________。
(5)下图所示为氧族元素单质与H2反应过程中的能量变化示意图,其中a、b、c、d分别表示氧族元素中某一元素的单质,纵坐标为相同物质的量的单质与H2反应过程中的能量变化(能量变化>0表示放热,能量变化<0表示吸热)。则:b代表___________ _____, d代表 (均写单质名称)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com