
| A、H2O2在反应①中作氧化剂,在反应②中作还原剂 | B、在H2O2分解过程中,溶液的pH逐渐减弱 | C、在H2O2分解过程中,Fe2+起到催化剂的作用 | D、H2O2生产过程要严格避免混入Fe2+ |


科目:高中化学 来源: 题型:阅读理解
过氧化氢(H2O2)又称双氧水,常温下它是一种液体,它难电离,且易分解。作为一种经典化工产品,工业上早在100多年前便开始生产。随着社会需求的增长,尤其是生态环境保护的需要,过氧化氢近年来更受到人们的青睐,并称其为绿色氧化剂。为了贮存、运输、使用的方便,工业上采用“醇析法”将其转化为固态的过碳酸钠晶体(其化学式为2Na2CO3·3H2O2),该晶体具有Na2CO3和H2O2的双重性质。“醇析法”的生产工艺过程如下:在0—5 ℃下,往饱和的Na2CO3溶液中,先加入H2O2和稳定剂(MgCl2和Na2SiO3),经充分反应后,再加入异丙醇,过滤分离,即得过碳酸钠晶体。
根据上述材料,完成下列问题:
(1)依据你已有的知识,写出H2O2的结构式__________,固态时属于__________晶体。
(2)你认为H2O2被称为绿色氧化剂的主要原因是:____________________________。
(3)我们知道,稀硫酸不与铜反应,但在稀硫酸中加入H2O2后,则可使铜顺利溶解,写出该反应的离子方程式_______________________________________。
(4)稳定剂能反应生成难溶物将过碳酸钠粒子包裹住,该反应的化学方程式为:________
___________________________________________。
(5)加入异丙醇的作用是____________________________________________。
(6)下列物质不会使过碳酸钠失效的是______________。
A.MnO2 B.H2S C.CH3COOH D.NaHCO3
(7)向含有酚酞的NaOH溶液中滴加双氧水,溶液由红色褪至无色,主要原因是双氧水的________性。
(8)将双氧水加入经酸化的高锰酸钾溶液中,溶液的紫红色消褪了,此时双氧水表现出________性;若用H218O2的双氧水与酸化的高锰酸钾反应,18O将存在生成物________里。
(9)久置的油画,白色部位(PbSO4)常会变黑(PbS),用双氧水揩擦后又恢复原貌,有关反应的化学方程式为_________________________________。若有0.1 mol的PbS参与反应,则在此反应中发生转移的电子为________mol。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市崇明县高三上学期期末(一模)考试化学试卷(解析版) 题型:填空题
部分弱酸的电离平衡常数如下表:
|
弱酸 |
HCOOH |
HClO |
H2CO3 |
H2SO3 |
|
电离平衡常数 (25℃) |
|
|
|
|
(1)在温度相同时,各弱酸的Ki值与酸性的相对强弱的关系为:________________________。
(2)下列离子方程式正确的是
A.2ClO- + H2O + CO2 → 2HClO + CO32-
B.2HCOOH + CO32- → 2HCOO- + H2O + CO2↑
C.H2SO3 + 2HCOO- → 2HCOOH + SO32-
D.Cl2 + H2O+2CO32- → 2HCO3- + Cl- + ClO-
(3)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为 。
亚硒酸(H2SeO3)也是一种二元弱酸,常温下是一种无色固体,易溶于水,有较强的氧化性。
(4)往亚硒酸溶液中不断通入SO2 会产生红褐色单质,写出该反应的化学方程式: 。
(5)将亚硒酸与30%的H2O2加热可制得硒酸(H2SeO4),反应方程式如下:
H2SeO3 + H2O2 → H2SeO4+H2O,下列说法中正确的是…………………………………( )
A.H2O2既是氧化剂又是还原剂
B.H2O 既不是氧化产物又不是还原产物
C.H2SeO4既是氧化产物又是还原产物
D.氧化性:H2SeO3>H2SeO4
碲酸(H6TeO6)是一种很弱的酸, ,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下:
,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下:
HI+ H6TeO6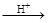 TeO2+ Te+ I2+ H2O
TeO2+ Te+ I2+ H2O
(6)若反应中生成的TeO2与Te的物质的量之比为 ,试配平上述化学方程式。
,试配平上述化学方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
在
根据上述材料,完成下列问题:
(1)依据你已有的知识,写出H2O2的结构式______________________。
(2)你认为H2O2被称为绿色氧化剂的主要原因是:________________。
(3)我们知道,稀硫酸不与铜反应,但在稀硫酸中加入H2O2,则可使铜顺利溶解,写出该反应的离子方程式_____________________。
(4)稳定剂能反应生成难溶物将过碳酸钠粒子包裹住,该反应的化学方程式为:___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com