
【题目】溶液、胶体和浊液这三种分散系的本质区别是( )。
A.是否有丁达尔现象 B.是否能通过滤纸
C.分散质粒子的大小 D.是否均一、透明、稳定
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B、C、D四种物质混和,发生如下反应:
aA+bB![]() cC(s)+dD
cC(s)+dD
当反应进行一定时间后,测得A减少了n mol,B减少了n /2mol,C增加了3n /2mol,D增加了n mol,此时达到化学平衡:
(1) 该化学方程式中各物质的化学计量数为:
a= 、b= 、c= 、d= 。
(2) 若只改变压强,反应速度发生变化,但平衡不发生移动,该反应中各物质的聚集状态:
A B D
(3)若只升高温度,反应一段时间后,测知四种物质其物质的量又达到相等则该反应为 反应(填“放热”或“吸热”)
查看答案和解析>>
科目:高中化学 来源: 题型:
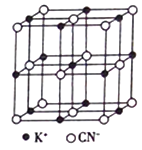
【题目】氰化钾(KCN)是一种有剧毒的物质,贮存和使用时必须注意安全。已知:KCN+H2O2=KOCN+H2O。回答下列问题:
(1)OCN-中所含三种元素的第一电离能从大到小的顺序为_________(用元素符号表示,下同),电负性从大到小的顺序为________;基态氮原子外围电子排布式为__________。
(2)H2O2中的共价键类型为_______(填“σ键”或“π键”) ,其中氧原子的杂化轨道类型为_________;分子中4个原子______(填“在”或“不在”)同一条直线上;H2O2易溶于水除它们都是极性分子外,还因为____________________。
(3)与OCN-键合方式相同且互为等电子体的分子为________(任举一例);在与OCN-互为等电子体的微粒中,由一种元素组成的阴离子是____________。
(4)KCN的晶胞结构如图所示。晶体中K+的配位数为_______,若其晶胞参数a=0.648nm,则KCN 晶体的密度为_______g/cm3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组在通过反应Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O研究反应速率的影响因素后,对Na2S2O3产生了兴趣,查资料知Na2S2O3的名称为硫代硫酸钠,可视为一个S原子取代了Na2SO4中的一个O原子。该实验小组运用类比学习的思想预测了Na2S2O3的某些性质,并通过实验探究了自己的预测。
【提出假设】
(1)部分学生认为Na2S2O3与Na2SO4结构相似,化学性质也相似,因此室温时Na2S2O3溶液的pH____7(填“>”、“=”或“<”)。
(2)部分学生从S元素化合价推测Na2S2O3与Na2SO4性质相似,均具有较强的____。
【实验探究】取适量Na2S2O3晶体,溶于水中制成Na2S2O3溶液,进行如下探究(填写表中空格)。
实验操作 | 实验现象 | 现象解释(用离子方程式表示) | |
探究① | (3)____ | 溶液pH=8 | (4)____ |
探究② | 向新制氯水(pH<2)中滴加少量Na2S2O3溶液 | 氯水颜色变浅 | (5)____ |
【实验结论】
(6)探究①__________。
(7)探究②__________。
【问题讨论】
(8)甲同学向“探究②”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化。你认为该方案是否正确并说明理由___________。
(9)请你重新设计一个实验方案,证明Na2S2O3被氯水氧化。你的方案是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将AgCl分别加入盛有:①5 mL水;②6 mL0.5mol/L NaCl溶液;③10 mL 0.2 mol/LCaCl2溶液;④50 mL0.1mol/L盐酸的烧杯中,均有固体剩余,各溶液中c(Ag+)从大到小的顺序排列正确的是 ( )
A. ④③②① B. ②③④① C. ①④③② D. ①③②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国化学家凯库勒认为苯分子的结构中,碳碳间以单、双键交替结合而成环状。 为了评价凯库勒的观点,某学生设计了以下实验方案:

实验操作:
①按上图所示的装置图连接好各仪器;
②检验装置的气密性;
③在 A 中加入适量的苯和液溴的混合液体,再加入少量铁粉,塞上橡皮塞,打开 K1、K2止水夹,关闭 K3 止水夹;
④待烧瓶 C 中气体收集满后,将导管 b 的下端插入烧杯里的水中,关闭 K2,打开 K3,挤 压预先装有水的胶头滴管的胶头,观察实验现象。
请回答下列问题:
(1)实验室可用 MnO2、NaBr 和浓硫酸混合共热制取单质溴,其中 MnO2 作氧化剂。写 出该反应的化学方程式:____。
(2)简述在实验操作步骤②中检验装置气密性的方法:_____________________;在实验过程中观察到装置 A 中有微沸现象,原因是_______________________。
(3)当 C 中观察到____,可证明凯库勒观点是错误的,以下 还可证明凯库勒观点错误的事实是________。
①6 个 C-H 键的长度相等
②6个碳碳键的长度都相等
③苯的一氯代物只有一种结构
④苯的邻二氯代物只有一种结构
⑤苯不能使酸性高锰酸钾溶液褪色
⑥苯不能使溴的四氯化碳溶液因加成而褪色
A.①②⑤⑥ B.②④⑤⑥ C.全部 D.①②③④⑤
(4)查阅文献:苯与液溴在 FeBr3 催化下的反应机理共分三步:
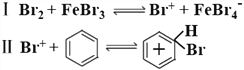
请完成第三步反应:Ⅲ____。
(5)将装置 A 内反应后的液体依次进行下列实验操作就可得到较纯净的溴苯:
①用蒸馏水洗涤,振荡,分液;②用 5%的 NaOH 溶液洗涤,振荡,分液;③用蒸馏水洗 涤,振荡,分液;④加人无水氯化钙干燥;⑤____(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一反应:2A+B![]() 2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,图中有a、b、c三点,如图所示,则下列描述正确的是
2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,图中有a、b、c三点,如图所示,则下列描述正确的是

A.该反应是放热反应
B.b点时混合气体的平均摩尔质量不再变化
C.T1温度下a点表示若想达到平衡,可以采取增大压强的方法
D.c点可表示v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意,完成下列问题。
(1)常温下,将1 mL 0.05mol/L的H2SO4溶液加水稀释至100 mL,稀释后溶液的pH= 。若将pH=5的硫酸溶液稀释500倍,稀释后溶液中c(SO42-):c(H+)= 。
(2)某温度时,测得0.01molL-1的NaOH溶液的pH为11,该溶液与pH=5的HCl溶液等体积混合(混合后溶液体积变化忽略不计),混合后溶液pH= 。
(3)常温下,pH=5的H2SO4溶液中由水电离出的H+的浓度为c1;pH=5的Al2(SO4)3溶液中由水电离出的H+的浓度为c2,溶液中![]() =_____________。
=_____________。
(4)常温下,pH=13的Ba(OH)2溶液aL与pH=3的H2SO4溶液bL混合(混合后溶液体积变化忽略不计),若所得混合溶液呈中性,则a :b=___________,若所得混合溶液pH=12,则a:b=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知15P、33As位于同一主族.下列关系正确的是( )
A.原子半径:As>Cl>P
B.非金属性:Cl>S>As
C.热稳定性:HCl>AsH3>PH3
D.酸性:H3AsO4>H2SO4>H3PO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com