
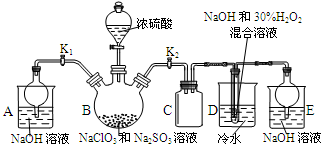
 亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,请回答:
亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,请回答:分析 (1)装置D中发生气体反应,装置内压强降低,装置C的作用是安全瓶,防止D瓶溶液倒吸到B瓶中;
(2)装置B中制备得到ClO2,所以B中反应为NaClO3和Na2SO3在浓H2SO4的作用生成 ClO2和Na2SO4,装置D反应后的溶液获得NaClO2晶体,装置D中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可知,还有水生成,配平书写方程式;B制得的气体中含有SO2,在装置D中被氧化生成硫酸,可以用利用硫酸钡是白色沉淀检验硫酸根;
(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,注意温度控制;
(4)反应结束后,打开K1,装置A中装有氢氧化钠溶液,可以吸收装置B中多余的ClO2和SO2,由题目信息可知,应控制温度38℃~60℃,高于60℃时NaClO2分解成NaClO3和NaCl;
(5)根据化学反应可得关系式:NaClO2~2I2~4S2O32-,令样品中NaClO2的物质的量x,根据关系式计算.
解答 解:(1)装置D中发生气体反应,装置内压强降低,装置C的作用是安全瓶,防止D瓶溶液倒吸到B瓶中,
故答案为:防止D瓶溶液倒吸到B瓶中;
(2)装置B中制备得到ClO2,所以B中反应为NaClO3和Na2SO3在浓H2SO4的作用生成 ClO2和Na2SO4,反应的方程式为2NaClO3+Na2SO3+H2SO4=2 ClO2↑+2Na2SO4+H2O,装置D反应后的溶液获得NaClO2晶体,装置D中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可知,还有水生成,配平后方程式为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2,B制得的气体中含有SO2,在装置D中被氧化生成硫酸,溶液中可能存在SO42-,用氯化钡溶液检验SO42-,具体操作:取少量反应后的溶液,先加足量的盐酸,再加BaCl2溶液,若产生白色沉淀,则说明含有SO42-,
故答案为:2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;SO42-;先加足量的盐酸,再加BaCl2溶液,若产生白色沉淀,则说明含有SO42-;
(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO2•3H2O,应趁热过滤,由题目信息可知,应控制温度38℃~60℃进行洗涤,低于60℃干燥,
故答案为:趁热过滤;60;
(4)反应结束后,打开K1,装置A中装有氢氧化钠溶液,可以吸收装置B中多余的ClO2和SO2,由题目信息可知,应控制温度38℃~60℃,高于60℃时NaClO2分解成NaClO3和NaCl,所以如果撤去D中的冷水浴,可能导致产品中混有的杂质是NaClO3和NaCl,
故答案为:吸收装置B中多余的ClO2和SO2;NaClO3和NaCl;
(5)令样品中NaClO2的物质的量x,则:
NaClO2~2I2~4S2O32-,
1mol 4mol
0.25x c mol•L-1×V×10-3L 解得:x=c•V•10-3mol
故答案为:c•V•10-3mol.
点评 本题考查亚氯酸钠制备实验的基本操作、亚氯酸钠的性质及中和滴定等知识,理解原理是解题的关键,同时考查学生分析问题、解决问题的能力,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A. | K+、Ba2+、Cl-、NO3- | B. | Na+、Cu2+、SO42-、OH- | ||
| C. | Na+、Cl-、Ca2+、MnO4- | D. | Na+、HCO3-、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向硫酸酸化的FeSO4溶液中加入过量的H2O2溶液:2Fe2++H2O2+2H+═2Fe3++2H2O | |
| B. | 用小苏打治疗胃酸过多:CO32-+2H+═CO2↑+H2O | |
| C. | 碳酸镁与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | 向Ca(HCO3)2溶液中加入过量的NaOH溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨烯是一种比钢铁更强韧的新型材料 | |
| B. | 大量使用化肥和农药,以提高农作物产量 | |
| C. | 道尔顿提出了原子论、门捷列夫提出了分子论 | |
| D. | 无论是风力发电还是潮汐发电,都是将化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 离子半径的大小:Na+>N3->H- | |
| B. | 它们与水发生的反应均属于氧化还原反应 | |
| C. | 两种化合物均只含离子键,不含共价键 | |
| D. | 两固体混合物溶于足量盐酸中可得到三种盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质硅是光导纤维的主要成分 | B. | 氯气可用于自来水杀菌消毒 | ||
| C. | 氧化铁常用作红色油漆和涂料 | D. | 过氧化钠可用作潜艇里氧气的来源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸和浓硝酸均具有强氧化性 | |
| B. | 浓硫酸和浓硝酸长期露置在空气中浓度均会增大 | |
| C. | 常温下浓硫酸和浓硝酸均不能用铝制容器贮存 | |
| D. | 浓硫酸和浓硝酸常温下均可以与Cu迅速反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com