


科目:高中化学 来源: 题型:
 表格中的各种情况,可以用如图的曲线表示的是( )
表格中的各种情况,可以用如图的曲线表示的是( )| 反 应 | 纵坐标 | 甲 | 乙 | |
| A | 相同质量的氨,在同一容器中2NH3═N2+3H2△H<0 | 氨气的转化率 | 500℃ | 400℃ |
| B | 等质量钾、钠分别与足量水反应 | H2质量 | 钠 | 钾 |
| C | 在体积可变的恒压容器中,体积比1:3的N2、H2, N2+3H2═2NH3 | 氨气的浓度 | 活性高的催化剂 | 活性一般的催化剂 |
| D | 2molSO2和1molO2,在相同温度下 2SO2+O2═2SO3 | SO3物质的量 | 2个大气压 | 10个大气压 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验示意图 | 实验现象 | 解释 |
甲: | 无明显现象 | |
乙: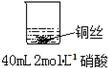 | 稀硝酸是氧化性的酸,能与铜发生反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O |
| 22 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石墨比金刚石稳定,故石墨转化为金刚石的反应可以自发进行 |
| B、吸热反应能自发进行的原因是从外界获得了能量 |
| C、Si02常温下可以与NaOH溶液和HF溶液反应,说明其具有两性 |
| D、反应A(g)+B(g)=2C(s)可以自发进行,则其必为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、28g以任意比组成的CO与N2混合气体中含有原子数为2NA |
| B、22.4L H2中含有氢原子的个数为2NA |
| C、在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移4NA个电子 |
| D、1L 1 mol/L 的盐酸中有NA 个HCl分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHSO3=Na++H++SO32- |
| B、BaSO4?Ba2++SO42- |
| C、S2-+2H2O?H2S+2OH- |
| D、HCl+H2O=H3O++Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 已知 | 类推 | |||||||||
| A | 将Fe加入CuSO4溶液中 Fe+Cu2+=Cu+Fe2+ | 将Na加入到CuSO4溶液中 2Na+Cu2+=Cu+2Na+ | ||||||||
| B | 向Ca(ClO)2溶液中通入少量CO2 Ca2++2ClO-+CO2+H2O=CaCO2↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2 Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO | ||||||||
| C | 用惰性电极电解NaCl溶液 2Cl-+2H2O
| 用惰性电极电解MgBr2溶液 2Br-+2H2O
| ||||||||
| D | 稀盐酸与NaOH溶液反应至中性 H++OH-=H2O | 稀HNO3与Ba(OH)2溶液反应至中性 H++OH-=H2O |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com