
| A. | 铝在空气中耐腐蚀,所以铝是不活泼金属 | |
| B. | 点燃的镁条插入盛有二氧化碳的集气瓶里,则迅速熄灭 | |
| C. | 铝在高温下能还原锰、铁、铬等金属的氧化物 | |
| D. | 因为镁和铝在空气中都能形成氧化膜,所以镁和铝都不溶于浓硝酸 |
分析 A.铝是亲氧元素,极易被氧气氧化生成氧化铝;
B.在点燃条件下,镁和二氧化碳发生氧化还原反应;
C.铝热反应可制备熔点较高的金属;
D.常温下,Al遇浓硝酸钝化,Al的氧化物为致密的结构.
解答 解:A.铝是亲氧元素,极易被氧气氧化生成氧化铝,致密的氧化物薄膜耐腐蚀,故A错误;
B.在点燃条件下,镁和二氧化碳发生氧化还原反应生成氧化镁和C,故B错误;
C.铝热反应可制备熔点较高的金属,则铝在高温下能还原锰、铁、铬等金属氧化物得到金属,故C正确;
D.常温下,Al遇浓硝酸钝化,Al的氧化物为致密的结构,加热时镁铝都能溶于浓硝酸,故D错误;
故选C.
点评 本题考查镁铝及其化合物的性质,把握元素化合物的性质是解本题关键,注意铝常温下和浓硝酸发生钝化现象,但加热条件下发生氧化还原反应,为易错点.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) | |
| B. | 升高温度,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$比值增大 | |
| C. | CH3COOH溶液中加少量的CH3COONa固体,醋酸的电离平衡逆向移动 | |
| D. | 0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①②④⑤⑥ | B. | 只有①②③④ | C. | 只有①②④ | D. | 都不行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
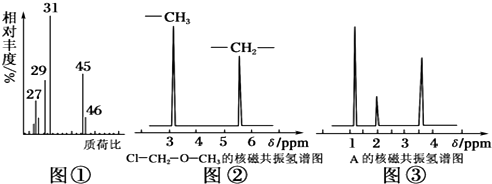
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g金属铁与足量的稀硫酸反应失去的电子数为0.3NA | |
| B. | 常温常压下,22.4L O2中含有氧原子个数为2NA | |
| C. | 2.8 g CO与等质量的C2H4含有相等的分子数,都为0.1NA | |
| D. | 1 mol•L-1NaCl溶液中含有Cl-的个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀合金材料的元素 | |
| B. | 在金属元素区域可以寻找制备新型农药材料的元素 | |
| C. | 在地球上元素的分布和它们在元素周期表中的位置有密切关系 | |
| D. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 时间 (min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 30 | 120 | 280 | 350 | 370 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
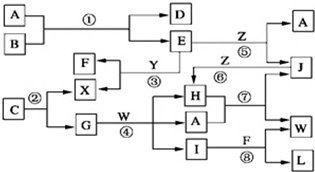
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 非金属元素只能形成共价化合物 | |
| B. | 在NaCl中,除Na+和Cl-的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用 | |
| C. | 任何离子键在形成过程中必定有电子的得与失 | |
| D. | 离子化合物可能含有共价键原子核之间的排斥作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com