
【题目】将22.4g铜和三氧化二铁的混合粉末加入到溶液为1mol/L的硫酸中,使之发生反应.
(1)若固体恰好全部溶解,消耗硫酸的体积为VL,则V的取值范围为 .
(2)若硫酸溶液过量,反应后的溶液体积为1L,测得此溶液中Fe2+浓度为0.1mol/L,则原混合物中含铜g.
【答案】
(1)0.3L≤V<0.42L
(2)3.2或14.4
【解析】解:(1)若固体恰好全部溶解,铜粉和三氧化二铁的混合物是按如下反应进行: Fe2O3+3H2SO4=Fe2 (SO4)3+3H2O、Cu+Fe2 (SO4)3=2FeSO4+CuSO4总反应方程式为:Cu+Fe2O3+3H2SO4=CuSO4+2FeSO4+3H2O若Cu、Fe2O3按物质的量1:1混合,消耗的硫酸最少,则n(Cu)=n(Fe2O3)= ![]() =0.1mol,由方程式可知,需要硫酸为0.1mol×3=0.3mol,硫酸体积为
=0.1mol,由方程式可知,需要硫酸为0.1mol×3=0.3mol,硫酸体积为 ![]() =0.3L,若混合物粉末全是Fe2O3 , 消耗的硫酸最多,则发生:Fe2O3+3H2SO4=Fe2 (SO4)3+3H2O,n(Fe2O3)=
=0.3L,若混合物粉末全是Fe2O3 , 消耗的硫酸最多,则发生:Fe2O3+3H2SO4=Fe2 (SO4)3+3H2O,n(Fe2O3)= ![]() =0.14mol,故消耗H2SO4为0.14 mol×3=0.42 mol,硫酸体积为
=0.14mol,故消耗H2SO4为0.14 mol×3=0.42 mol,硫酸体积为 ![]() =0.42L,但铜的质量不可能为0,故有0.3L≤V<0.42L,所以答案是:0.3L≤V<0.42L;(2)溶液中n(Fe2+)=1L×0.1mol/L=0.1mol,则
=0.42L,但铜的质量不可能为0,故有0.3L≤V<0.42L,所以答案是:0.3L≤V<0.42L;(2)溶液中n(Fe2+)=1L×0.1mol/L=0.1mol,则
Cu+Fe2O3+3H2SO4=CuSO4+2FeSO4+3H2O
0.05mol 0.05mol 0.1mol
若铜过量,过量的铜不与硫酸反应,则m (Fe2O3)=0.05 mol×160 g/mol=8.0 g,故m (Cu)=22.4 g﹣8.0 g=14.4 g;若Fe2O3过量,过量的Fe2O3将与H2SO4反应,则m (Cu)=0.05mol×64 g/mol=3.2g,所以答案是:3.2或14.4.


科目:高中化学 来源: 题型:
【题目】向100ml某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2 , 充分反应后,向所得溶液中逐滴滴入1mol/L的盐酸溶液,所得气体的体积(标准状态)与所加盐酸的体积关系如图所示
(1)写出OA+段发生反应的离子方程式:。
(2)反应到B点时所得溶液中的溶质是。
(3)原NaOH溶液的物质的量浓度是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合溶液中所含离子的浓度如下表,则M离子可能为
所含离子 | Cl- | SO42- | H+ | M |
浓度 /(mol·L-1) | 2 | 1 | 2 | 1 |
A. Na+ B. Al3+ C. NO3- D. Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验目的可以实现或操作正确的是
A. 用托盘天平称取3.23gNaCl固体
B. 用10mL量筒量取7.50mL稀盐酸
C. 蒸馏时冷凝聚管中冷却水流向是上口进下口出
D. 稀释浓硫酸时,把浓硫酸沿器壁慢慢注入水里,并不断搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3及其盐都是重要的化工原料. 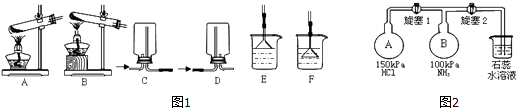
(1)用NH4Cl和Ca(OH)2制备NH3的化学方程式为;该反应发生、气体收集和尾气处理装置如图1依次为;
(2)按如图2装置进行NH3性质实验.先打开旋塞1,B瓶中的现象是 , 稳定后,关闭旋塞1.再打开旋塞2,B瓶中的现象是;
(3)写出NH4Cl溶液水解的离子方程式;
设计实验,探究某一种因素对溶液中NH4Cl水解程度的影响.
限选试剂与仪器:固体NH4Cl、蒸馏水、250mL容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、pH计、温度计、恒温水浴槽(可调控温度)
①实验目的:探究对溶液中NH4Cl水解程度的影响;
②设计实验方案,拟定实验表格,完整体现实验方案(列出能直接读取数据的相关物理量及需拟定的数据,数据用字母表示;表中“V(溶液)”表示所配制溶液的体积).
物理量 | V(溶液)/mL | NH4Cl质量/g | 温度/℃ | … | |
1 | 250 | X | … | ||
2 | 250 | … |
③按实验序号1所拟数据进行实验,若读取的待测物理量的数值为X,则NH4Cl水解反应的平衡转化率为(只列出算式,忽略水自身电离的影响).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是我国化学家近年来合成的两种聚乙炔衍生物分子的结构式. 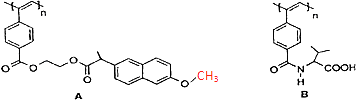
下列说法正确的是( )
A.A和B均能在一定条件下水解,且水解均生成两种产物
B.A水解生成的高分子化合物中所有碳原子一定共面
C.A和B的链节中均含有2个以上手性碳原子
D.1molA和B各与热碱液反应,均最多消耗2n mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.在常温常压下,11.2LN2所含有的分子数为0.5NA
B.在标准状况下, 22.4 L CO和N2的混合物的物质的量为1mol
C.在标准状况下, 18g H2O的体积为22.4 L
D.1mol SO2的体积为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象所对应的离子方程式不正确的是( )
实验 | 现象 | 离子方程式 | |
A |
| 在空气里放置一段时间后溶液呈蓝色 | 4H++4I﹣+O2═2I2+2H2O |
B |
| 开始时无气泡,后来有气泡 | CO32﹣+H+═HCO3﹣ |
C |
| 溶液由黄绿色变为无色 | Cl2+2OH﹣═Cl﹣+ClO﹣+H2O |
D |
| 有白色沉淀生成,溶液由红色变为无色 | Ba2++OH﹣+H++SO42﹣═BaSO4↓+H2O |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象描述不正确的是
选项 | 实验 | 现象 |
A | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝并不滴落,好像有一层膜兜着 |
C | 点燃的镁条伸入盛有O2的集气瓶(底部铺有少量细沙)中 | 镁条继续燃烧,发出耀眼白光放出大量热量,生成白色固体 |
D | 在空气中久置的铝条放入NaOH溶液中 | 立刻产生大量无色气泡,铝条逐渐变细,铝条逐渐发热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com