
下列使用化肥、农药的描述中正确的是( )
| A.高温多雨时比较适合施用钾肥 |
| B.长期施用硫铵会造成土壤板结 |
| C.石硫合剂必须与硫酸混合后才能施用 |
| D.草木灰可以和铵态氮肥一块施用 |
科目:高中化学 来源: 题型:填空题
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成为是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下: 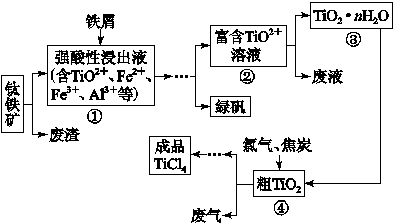
回答下列问题:
往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe=3Fe2+
2TiO2+(无色)+Fe+4H+=2Ti3+(紫色) +Fe2++2H2O
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
加入铁屑的作用是 。
(2)在②→③工艺过程中需要控制条件以形成TiO2·nH2O溶胶,该溶胶的分散质颗粒直径大小在 范围。
(3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的Fe(OH)3杂质,还可以制得钛白粉。已知25 ℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+ Fe3++3H2O的平衡常数K= 。
Fe3++3H2O的平衡常数K= 。
(4)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
写出④中TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式: 。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是 (只要求写出一项)。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4的,可采用 方法。
| | TiCl4 | SiCl4 |
| 熔点/℃ | -25.0 | -68.8 |
| 沸点/℃ | 136.4 | 57.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于化工生产的叙述中,符合目前工业生产实际的是
| A.石油工业中,采用干馏的方法把石油分成不同沸点范围的产品 |
| B.硝酸工业中,为了加快氨氧化的速率,通常使用铁触媒作催化剂 |
| C.纯碱工业中,氨碱法通过氨气和二氧化碳的循环利用,提高了原料的利用率 |
| D.合成氨工业中,采用高压条件,增大合成氨反应的平衡常数,增大原料转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
合成氨工业、硫酸工业的生产工艺流程大致为:
合成塔和接触室中的反应分别为:N2(g)+3H2(g)  2NH3(g) △H﹤0; 2SO2(g)+O2(g)
2NH3(g) △H﹤0; 2SO2(g)+O2(g)  2SO3(g) △H﹤0
2SO3(g) △H﹤0
(1)写出流程中设备的名称:B ,X 。
(2)进入合成塔和接触室中的气体都要进行热处理,最理想的热处理方法是 。
(3)采用循环操作可提高原料的利用率,下列生产中,采用循环操作的是 (填序号)。
①硫酸工业 ②合成氨工业 ③硝酸工业
(4)工业上常用98.3%的浓硫酸吸收SO3而不用稀硫酸或水的原因是 。
(5)工业生产中常用氨——酸法进行尾气脱硫,以达到消除污染、废物利用的目的。硫酸工业尾气中的SO2经处理可以得到一种化肥,该肥料的化学式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
现代工业上用氨与二氧化碳在高压下反应,先生成氨基甲酸铵,再脱水生成尿素。反应式为2NH3+CO2 NH2COONH4;NH2COONH4
NH2COONH4;NH2COONH4 CO(NH2)2+H2O
CO(NH2)2+H2O
根据已学知识推断起固氮作用的化学反应是( )
| A.NO2与H2O的反应生成HNO3和NO | B.NO与O2反应生成NO2 |
| C.NH3经催化氧化生成NO | D.N2 蛋白质 蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
【化学--选修2化学与技术】(15分)
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下: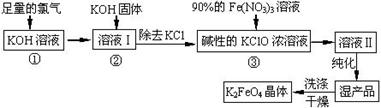
已知:2KOH + Cl2 ═ KCl + KClO + H2O(条件:温度较低)
6KOH + 3Cl2 ═ 5KCl + KClO3 + 3H2O(条件:温度较高)
回答下列问题:
(1)该生产工艺反应①应在 (填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4具有强氧化性的原因 ;
(4)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体( 该溶液的密度为1.47 g/mL),它
的物质的量浓度为 ;
(5)在“溶液I”中加KOH固体的目的是 :
| A.与 “溶液I” 中过量的Cl2继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
| C.为下一步反应提供反应物 |
| D.使副产物KClO3转化为 KClO |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
【化学与技术】
世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时要避免光照、震动或加热。实验室以电解法制备ClO2的流程如下:请回答下列问题。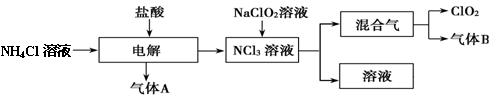
(1)ClO2中所有原子 (填“是”或“不是”)都满足8电子结构。上图所示电解法制得的产物中杂质气体B能使石蕊试液显蓝色,除去杂质气体可选用 。
A饱和食盐水 B碱石灰 C浓硫酸 D蒸馏水
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品,下列说法正确的是 。
| A.二氧化氯可广泛用于工业和饮用水处理 |
| B.应用在食品工业中能有效地延长食品贮藏期 |
| C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围 |
| D.在工作区和成品储藏室内,要有通风装置和监测及警报装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于化工生产原理的几种叙述中,均符合目前工业生产实际情况的是( )。
| A.石油是烃的混合物,石油工业中采用干馏的方法把石油分成不同沸点范围的产物 |
| B.氯气和氢气混合在光照条件下生成氯化氢,再用水吸收生成盐酸 |
| C.二氧化硫在接触室被氧化成三氧化硫,再在吸收塔内被水吸收制成浓硫酸 |
| D.合成氨工业中,由于氨易液化,N2、H2循环使用,所以总体来说氨的产率很高 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列化学肥料均属于复合肥料的是( )。
| A.KH2PO4和NH4Cl | B.NH4Cl和NH4NO3 |
| C.KNO3和KH2PO4 | D.NH4Cl和KNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com