
 2SO3(g),已知c(SO2)始=0.4 mol·L-1,c(O2)始=1 mol·L-1,经测定该反应在该温度下的平衡常数K=19,则此反应中SO2的转化量为 ( )
2SO3(g),已知c(SO2)始=0.4 mol·L-1,c(O2)始=1 mol·L-1,经测定该反应在该温度下的平衡常数K=19,则此反应中SO2的转化量为 ( )| A.0.24 mol·L-1 | B.0.28 mol·L-1 |
| C.0.32 mol·L-1 | D.0.26 mol·L-1 |
科目:高中化学 来源:不详 题型:单选题
 3B(?)+C(?)(正反应吸热),随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是 ( )
3B(?)+C(?)(正反应吸热),随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是 ( )| A.B和C可能都是固体 | B.B和C一定都是气体 |
| C.若C为固体,则B一定是气体 | D.B和C可能都是气体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2CO2 + N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
2CO2 + N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol·L-1 | 1.00×10-3 | 4.50× 10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )
4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )A.该反应的化学平衡常数表达式是K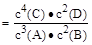 |
| B.此时,B的平衡转化率是40% |
| C.增大该体系的压强,平衡向右移动,化学平衡常数增大 |
| D.增加B,平衡向右移动,B的平衡转化率增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Z(g);若X、Y、Z起始浓度分别为C1、C2、C3(均不为0),平衡时X、Y、Z的浓度分别为0.1mol/L、0.3 mol/L、0.08 mol/L,则下列判断不合理的是
2Z(g);若X、Y、Z起始浓度分别为C1、C2、C3(均不为0),平衡时X、Y、Z的浓度分别为0.1mol/L、0.3 mol/L、0.08 mol/L,则下列判断不合理的是 
| A.C1:C2=1:3 | B.平衡时,Y和Z的生成速率之比为3 :2 |
| C.反应过程中X、Y的转化率不相等 | D.C1取值范围为0<C1<0.14 mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学平衡常数不随反应物或生成物的浓度的改变而改变? |
| B.化学平衡常数随温度的改变而改变? |
| C.对于一定温度下的同一个反应,其正反应和逆反应的化学平衡常数的乘积等于1? |
| D.温度越高,K值越大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据右图可得出的判断结论正确的是
2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据右图可得出的判断结论正确的是 
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 3C(g)达到平衡时,测得c(A)=0.5 mol/L。在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得c(A)=0.25 mol/L。下列判断中正确的是( )
3C(g)达到平衡时,测得c(A)=0.5 mol/L。在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得c(A)=0.25 mol/L。下列判断中正确的是( )查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2AB(g) 在一定条件下,达到平衡状态的标志是( )
2AB(g) 在一定条件下,达到平衡状态的标志是( )| A.单位时间内,生成n mol A2的同时,生成n mol的B2 |
| B.单位时间内生成2n mol AB的同时,生成n mol的B2 |
| C.平衡时容器内的总压强不随时间而变化 |
| D.平衡时容器内各物质的物质的量比为1∶1∶2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com