
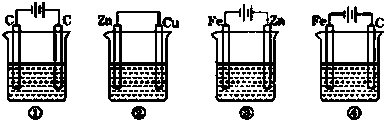


科目:高中化学 来源: 题型:
| A、O2和O3的混合气体共6.4g,其中所含氧原子数一定为0.4NA |
| B、将标准状况下22.4L NO与11.2L O2混合后的体积约为22.4L |
| C、在反应KClO4+8HCl═KCl+4Cl2↑+4H2O中,每生成4mol Cl2转移的电子数为8NA |
| D、标准状况下11.2L Cl2溶于1L水中,转移电子的数目为0.5NA |
查看答案和解析>>
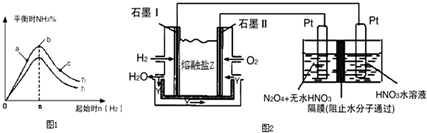
科目:高中化学 来源: 题型:
| t/s | 0 | 50 | 100 |
| c(N2O5)/mol?L-1 | 5.0 | 3.5 | 2.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
| 时间/min | CO2(mol/L) | H2(mol/L) | CO(mol/L) | H2O(mol/L) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
查看答案和解析>>
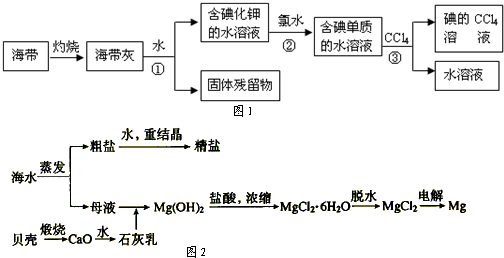
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、工作一段时间后,锌片质量会减轻 |
| B、电池工作时,铜电极附近会出现蓝色 |
| C、锌片失去的电子通过番茄汁流向铜电极 |
| D、铜电极发生还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com