
| A. | △H1<△H3 | B. | △H3=△Hl+△H2 | ||
| C. | 反应①的活化能为24.4 kJ•mol-1 | D. | 反应③一定不能自发进行 |
分析 已知①MnO2(s)+C(s)═MnO(s)+CO(g)△H=+24.4kJ•mol-1,②MnO2(s)+CO(g)═MnO(s)+CO2(g)△H=-148.1kJ•mol-1,依据盖斯定律:①+②得:2MnO2(s)+C(s)═2MnO(s)+CO2(g)△H3=-123.7 kJ•mol-1,如能自发进行,应满足△H-T•△S<0,以此解答该题.
解答 解:①+②得:2MnO2(s)+C(s)═2MnO(s)+CO2(g)△H3=-123.7 kJ•mol-1,
A.△H1=+24.4kJ•mol-1,△H3=-123.7 kJ•mol-1,则△H1>△H3,故A错误;
B.由以上分析可知△H3=△Hl+△H2,故B正确;
C.24.4 kJ•mol-1为反应①的反应热,不是活化能,故C错误;
D.反应③△H<0,△S>0,则△H-T•△S<0,可自发进行,故D错误.
故选B.
点评 本题考查化学反应与能量变化,为高频考点,侧重考查学生的分析能力和计算能力,注意把握盖斯定律的应用,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 四种元素在自然界中都有游离态 | |
| B. | X分别与W、Y、Z都可组成具有漂白性的物质,且它们的漂白原理相同 | |
| C. | 元素W、Y的氯化物中,各原子(或离子)均满足8电子的稳定结构 | |
| D. | 元素W可与元素X形成一种既含极性键又含非极性键的共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用湿润的蓝色石蕊试纸检验某种气体是否是NH3 | |
| B. | 某种有色溶液可使淀粉-KI试纸变蓝色,则该溶液中一定含有Fe3+ | |
| C. | 用玻璃棒蘸取溶液点在用蒸馏水湿润过的pH试纸上可测量该溶液的pH | |
| D. | 将湿润的蓝色石蕊试纸片粘在玻璃棒上置于氯气中,试纸先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×l0-10 |
| CH3COOH | K=1.8×l0-5 |
| H2CO3 | K1=4.3×l0-7、K2=5.6×l0-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl晶体 BaSO4 | B. | 铜 二氧化硫 | ||
| C. | 液态的醋酸 酒精 | D. | 熔融的KNO3 硫酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
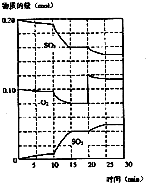 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应的进行程度越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应的进行程度越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入催化剂,改变了反应的途径,反应的△H也随之改变 | |
| B. | 增大压强,正逆反应的化学反应速率都减小 | |
| C. | 升高温度,正反应化学反应速率增大,逆反应化学反应速率减 | |
| D. | 对该反应来说,无沦反应进行到何时,混合气体的总物质的量不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com