
【题目】某烃的衍生物W,仅含C、H、O三种元素.测其密度是相同条件下H2的45倍,各元素的质量百分含量如下表:
C% | H% | O% |
40.00% | 6.67% | 53.33% |
已知,W既能与乙酸反应,又能与乙醇反应,生成物都是酯和水。W的核磁共振氢谱图中有四种吸收峰,面积之比为3:1:1:1。
求:(1)W的相对分子质量为___;
(2)试计算确定W的分子式:___;
(3)W的结构简式为:___。
【答案】90 C3H6O3 CH3CH(OH)COOH
【解析】
⑴根据密度之比等于摩尔质量之比,等于相对密度,计算出有机物的相对分子质量。
⑵根据质量分数计算出碳、氢、氧的个数比,计算出最简比,再根据相对分子质量计算出分子式。
⑶W既能与乙酸反应,又能与乙醇反应,生成物都是酯和水,说明W含有—OH、—COOH,再根据核磁共振氢谱图中有四种吸收峰得出结构简式。
⑴有机物质的密度是相同条件下H2的45倍,所以有机物质的相对分子质量=45×2=90,故答案为:90。
⑵![]() ,所以设分子为(CH2O)n,结合相对分子质量为90,30n =90,得n=3,因此分子式为C3H6O3,故答案为:C3H6O3。
,所以设分子为(CH2O)n,结合相对分子质量为90,30n =90,得n=3,因此分子式为C3H6O3,故答案为:C3H6O3。
⑶W既能与乙酸反应,又能与乙醇反应,生成物都是酯和水,说明W的结构中有,—OH、—COOH,核磁共振氢谱图中有四种吸收峰,面积之比为3:1:1:1,得结构简式为CH3CH(OH)COOH;故答案为:CH3CH(OH)COOH。


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】图1为铁在一定条件下的转化关系图。

请回答:
(1)“曾青得铁则化为铜”的反应有:Fe + CuSO4 = FeSO4 + Cu,该反应的还原剂是_____________(填化学式);
(2)工业上,向500-600℃的铁屑中通入Cl2生产FeCl3,向FeCl3溶液中滴加KSCN溶液,观察到的现象是溶液变成____________色;
(3)图2为原电池装置示意图,此装置可以把化学能转化为_________能,其中铁作_____极;

(4)Fe3O4中Fe既有+2价又有+3价,则+2价和+3价Fe的个数比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇燃料电池采用硫酸作为电解质溶液,是一种可再生清洁的电池,电池的示意图如图,电池总反应式为C2H5OH+3O2=2CO2+3H2O。
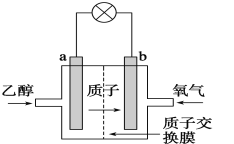
(1)a是___极(选“正”或“负”),发生___反应;电流由___极流向___极(选“a”或“b”),SO42-移向___极(选“a”或“b”)。
(2)随着电池的不断放电,硫酸溶液的物质的量浓度将___。(选“变大”或“不变”或“变小”)
(3)电池的负极电极反应式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴的化合物在工业生产、生命科技等行业有重要应用。
(1)基态Co2+的核外电子排布式为____。
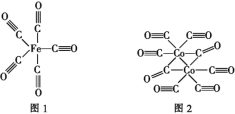
(2)Fe、Co均能与CO形成配合物,如Fe(CO)5、Co2(CO)8的结构如图1、图2所示,图1中1 mol Fe(CO)5含有____mol配位键,图2中C原子的杂化方式为____,形成上述两种化合物的四种元素中电负性最大的是____(填元素符号)。
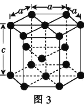
(3)金属钴的堆积方式为六方最密堆积,其配位数是____,钴晶体晶胞结构如图3所示,该晶胞中原子个数为____;该晶胞的边长为a nm,高为c nm,该晶胞的密度为____(NA表示阿伏加德罗常数的值,列出代数式)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列原子或原子团,请按要求选择两个,写出符合要求的有机物的结构简式:﹣CH3、﹣OH、﹣CHO、﹣COOH、﹣Br、﹣H、﹣CH2CH3、![]()
(l)分子结构为正四面体的是:___;
(2)能使FeCl3溶液显紫色的是:___;
(3)在NaOH乙醇溶液中能发生消去反应的是:____;
(4)1mol该有机物与足量的银氨溶液反应,有4molAg生成的是:___;
(5)相对分子质量是60,能和NaHCO3反应放出CO2的是:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素![]() 的原子序数依次增大,其中
的原子序数依次增大,其中![]() 位于同一主族。
位于同一主族。![]() 的气态氢化物常用作制冷剂。
的气态氢化物常用作制冷剂。![]() 与水剧烈反应,可观察到液面上有白雾生成,并有刺激性气味的气体逸出,该气体可使品红溶液褪色。下列说法正确的是( )
与水剧烈反应,可观察到液面上有白雾生成,并有刺激性气味的气体逸出,该气体可使品红溶液褪色。下列说法正确的是( )
A.最简单氢化物的沸点:![]()
B.原子半径:![]()
C.把![]() 通入石蕊试液中,石蕊先变红后褪色
通入石蕊试液中,石蕊先变红后褪色
D.向![]() 与水反应后的溶液中滴加
与水反应后的溶液中滴加![]() 溶液有白色沉淀生成
溶液有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如右图所示。已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1。请回答下列问题:
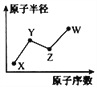
(1)写出四种元素的元素符号:X____ Y____ Z____ W____
(2)HYO3的酸性比HWO强,有人据此认为Y的非金属性强于W,你认为这种看法是否正确___,说明理由__________________________________。
(3)甲和乙分别是由W、X、Y、Z四种元素中的三种元素组成的常见化合物,化合物甲具有漂白消毒杀菌作用,其化学式为________;化合物乙是一种常见的强酸,会因保存不当而变成黄色液体,其原因是_______________________________。把红热的木炭投入黄色液体,剧烈反应,方程式为_____________________,将产生的气体通过澄清石灰水时气体变为无色,但未见有浑浊现象,原因是______________。(写出有关反应的化学方程式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷和镍均为重要的无机材料,在化工领域具有广泛的应用。
(1)基态As原子的价层电子的电子云轮廓图形状为_____________。与砷同周期的主族元素的基态原子中,第一电离能最大的为_____________(填元素符号。)
(2)Na3AsO3可用于碘的微量分析。
①Na+的焰色反应呈黄色,金属元素能产生焰色反应的微观原因为__________________________。
②Na3AsO3中所含阴离子的立体构型为_____________,写出一种与其互为等电子体的分子:_____________(填化学式)。
(3) 可用于合成Ni2+的配体,M中C原子的杂化方式为___________,其所含
可用于合成Ni2+的配体,M中C原子的杂化方式为___________,其所含![]() 键和π键的数目之比为___________。
键和π键的数目之比为___________。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为___________。区分晶体Ni和非晶体Ni的最可靠的科学方法为___________。
(5)某砷镍合金的晶胞结构如下图所示,设阿伏加德罗常数的值为NA,则该晶体的密度ρ=___________g·cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光卤石(组成为KCl·MgCl2·nH2O)是制取钾肥和冶炼金属镁的重要原料。为测定光卤石的组成,某化学小组在实验室进行如下实验。回答下列问题:
(一)光卤石中结晶水含量测定,所用装置如图所示。
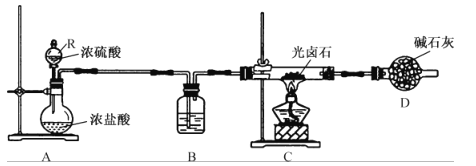
(1)装置A的作用是_____________,其中仪器 R的名称是_______。装置B盛放的试剂是______;装置D的作用是_____________________________。
(2)实验包括如下步骤,正确的先后顺序为____________(填序号)。
①点燃装置C中的酒精灯;②打开装置A中R的活塞;③组装仪器,并检查装置的气密性;④装入药品;⑤关闭装置A中R的活塞;⑥熄灭装置C中的酒精灯。
(3)写出装置C中硬质玻璃管内发生反应的化学方程式:________________________(光卤石用“KCl·MgCl2·nH2O”表示)。
(4)若装置C中硬质玻璃管的质量为ag,实验前称量得硬质玻璃管和样品的总质量为bg,充分反应并冷却后,称量得硬质玻璃管和剩余固体的总质量为cg。则KCl·MgCl2·nH2O中n=______(用含a、b、c的代数式表示)。
(二)测定纯净的光卤石中Mg2+的质量分数。
取wg纯净的光卤石溶于稍过量的稀硝酸中,再用水稀释,配制成250mL溶液。取25.00 mL溶液于锥形瓶中,滴几滴K2CrO4溶液(作指示剂),用c mol·L-1的AgNO3标准溶液滴定至终点,消耗V mL AgNO3标准溶液。
(5)纯净的光卤石中所含镁元素的质量分数为_____%(用含w、c、V的代数式表示)。
(6)其他操作均正确,若滴定开始时仰视读数,滴定终点时俯视读数,则测得的结果会_____(填“偏高”偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com