
 将一个装有饱和石灰水的试管放入盛有25℃饱和石灰水的广口瓶中,如图所示.
将一个装有饱和石灰水的试管放入盛有25℃饱和石灰水的广口瓶中,如图所示.

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
| A、钢铁在潮湿空气中发生吸氧腐蚀,负极反应为Fe-3e-═Fe3+ |
| B、相同条件下,轮船在海水中比在淡水中腐蚀慢 |
| C、铁上镀锌的保护方法叫牺牲负极的正极保护法 |
| D、水库里钢闸门与电源负极相连的方法叫做外加电源的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
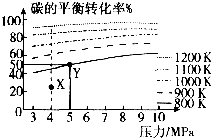 已知给煤炭加氢可发生反应:C(s)+2H2(g)?CH4(g).在VL的容器中投入amol碳(足量),同时通入2amolH2,控制条件使其发生上述反应,测得碳的平衡转化率随压强及温度的变化关系如下图所示.下列说法正确的是( )
已知给煤炭加氢可发生反应:C(s)+2H2(g)?CH4(g).在VL的容器中投入amol碳(足量),同时通入2amolH2,控制条件使其发生上述反应,测得碳的平衡转化率随压强及温度的变化关系如下图所示.下列说法正确的是( )| A、上述正反应为放热反应 | ||
| B、在4MPa、1200K时,图中X点v(H2)正>v(H2)逆 | ||
C、在5MPa、800K时,该反应的平衡常数为
| ||
| D、工业上维持6MPa1000K而不采用10MPa1000K,主要是因为前者碳的转化率高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 不同时间各物质的物质的量/mol | |||||
| 0min | 1min | 2min | 3min | 4min | |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:






查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钢铁的腐蚀过程中,析氢腐蚀与吸氧腐蚀不可能同时发生 |
| B、反应NH4Cl(s)=NH3(g)+HCl(g)在室温下不能自发进行,则该反应的△H>0 |
| C、由于Ksp(BaSO4)<Ksp(BaCO3),因此BaSO4沉淀不可能转化为BaCO3沉淀 |
| D、25℃时,0.1 mol?L-1CH3COOH溶液加水稀释后,c(OH-)/c(CH3COOH)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②⑤ | B、①③⑤ |
| C、②③④ | D、①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com