
| A. | 制备氯气时严格检查装置的气密性,并设置尾气吸收装置 | |
| B. | 稀释浓硫酸时,将水倒入浓硫酸中,使用玻璃棒不断搅拌 | |
| C. | 在敞口容器中进行铜与浓硝酸的反应,并观察生成的气体 | |
| D. | 向一支试管中加入少量水,向其中投入一块黄豆大小的钠 |
分析 A.氯气有毒,能够引起空气污染;
B.浓硫酸密度大于水,溶于水产生大量的热;
C.铜与浓硝酸反应生成二氧化氮,二氧化氮有毒;
D.钠与水反应在试管中进行实验可能因为放出的热不能迅速散失而使生成的氢气燃烧并发生爆炸.
解答 解:A.氯气有毒,能够引起空气污染,所以制备氯气时严格检查装置的气密性,并设置尾气吸收装置,故A正确;
B.浓硫酸密度大于水,溶于水产生大量的热,稀释的正确操作:将浓硫酸沿着烧杯壁缓缓注入水中,同时用玻璃棒不断搅拌,故B错误;
C.铜与浓硝酸反应生成二氧化氮,二氧化氮有毒,所以进行铜与浓硝酸反应实验不能用敞口仪器进行,故C错误;
D.钠与水反应应该在烧杯中进行,在试管中进行实验可能因为放出的热不能迅速散失而使生成的氢气燃烧并发生爆炸,故D错误;
故选:A.
点评 本题主要考查化学实验,化学实验是考查的重点、难点和热点,特别是基本操作,了解仪器的使用方法和操作的注意事项是解题的关键,题目难度不大.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:多选题
| A. | 向含有澄清石灰水中通入CO2至产生的沉淀恰好溶解时,若加入NaOH溶液,可观察到沉淀生成 | |
| B. | 向Na2CO3、NaHCO3 的混合溶液中滴加盐酸溶液,均可观察到立即产生气体 | |
| C. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ | |
| D. | 向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
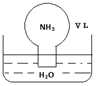 标准状况下,将体积为V L充满氨气的圆底烧瓶倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出,所得溶液的密度为ρg•cm-3.下列说法错误的是( )
标准状况下,将体积为V L充满氨气的圆底烧瓶倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出,所得溶液的密度为ρg•cm-3.下列说法错误的是( )| A. | 水最终会充满整个烧瓶 | |
| B. | 所得溶液的物质的量浓度为 $\frac{1}{22.4}$mol•L-1 | |
| C. | 所得溶液的质量分数为$\frac{17}{22400}$ρ | |
| D. | 将氨气换为二氧化氮,所得溶液的物质的量浓度也为$\frac{1}{22.4}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
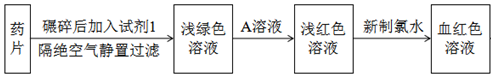
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
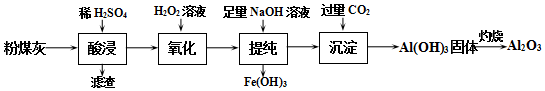
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com