
|
下列物质中,所有的原子都在同一平面上的分子是 | |
| [ ] | |
A. |
氨气 |
B. |
乙烷 |
C. |
甲烷 |
D. |
乙烯 |
科目:高中化学 来源: 题型:
 (2012?上饶二模)某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )
(2012?上饶二模)某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
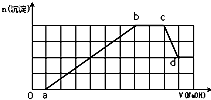 某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如图所示,下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如图所示,下列说法正确的是( )| A、d点溶液中含有的溶质只有Na2SO4 | B、原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 | C、ab段发生的离子反应为:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓ | D、原溶液中含有的阳离子必定有H+、NH4+、Al3+,但不能肯定Mg2+和Fe3+中的哪一种 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市崇明县高三上学期期末(一模)考试化学试卷(解析版) 题型:实验题
粗CuO是将工业废铜、废铜合金等高温焙烧而成的,杂质主要是铁的氧化物及泥沙。以粗CuO为原料制备胆矾的主要流程如下:

经操作I得到粗胆矾,操作III得到精制胆矾。两步操作相同,具体包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤。
已知: 、
、 、
、 转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
|
|
|
|
|
|
开始沉淀时的pH |
2.7 |
7.6 |
5.2 |
|
完全沉淀时的pH |
3.7 |
9.6 |
6.4 |
(1)溶解、过滤需要用到玻璃棒,它的作用是 。
(2)写出加入3% H2O2后发生反应的离子方程式 。(原溶液显酸性)。
(3)加稀氨水调节pH应调至范围 。下列物质可用来替代稀氨水的是 。(填字母)
A.NaOH B.Cu(OH)2 C.CuO D.NaHCO3
(4)操作III析出胆矾晶体后,溶液中还可能存在的溶质为CuSO4、H2SO4、________________。
(5)某学生用操作III所得胆矾进行“硫酸铜晶体结晶水含量”的测定,数据记录如下表所示:
|
|
第一次实验 |
第二次实验 |
|
坩埚质量(g) |
14.520 |
14.670 |
|
坩埚质量 |
17.020 |
18.350 |
|
第一次加热、冷却、称量(g) |
16.070 |
16.989 |
|
第二次加热、冷却、称量(g) |
16.070 |
16.988 |
两次都无须再做第三次加热、冷却、称量,理由是 ,该生此次实验的相对误差为 %(保留1位小数),产生实验误差的原因可能是
(填字母)。
A.加热前称量时坩埚未完全干燥 B.该胆矾中含有受热不分解的杂质
C.加热后坩埚放在干燥器中冷却 D.玻璃棒上沾有的固体未刮入坩埚
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如右图所示变化:
X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如右图所示变化:
已知一个B分子中含有的Z元素的原子个数比一个C分子中少1个。
请回答下列问题:
(1)X元素在周期表中的位置是 ;
(2)X单质与Z单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性炭制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入 (填名称)气体;负极电极反应式为 ;
(3)C在一定条件下反应生成A的化学方程式是;
(4)已知Y单质与Z单质生成C的反应是可逆反应,△H<0。将等物质的量的Y、Z两种单质充入一密闭容器中,在适当催化剂和恒温条件下反应。下列说法中正确的是 (填写字母编号);
a.达到化学平衡时,正反应速率与逆反应速率相等
b.反应过程中,Y单质的体积分数始终为50%
c.达到化学平衡时,Y、Z两种单质在混合气体中的物质的量之比为1∶1
d.达到化学平衡的过程中,气体平均相对分子质量逐渐增大
e.达到化学平衡后,再升高温度,C的体积分数增大
(5)在一个体积为10L的密闭容器中,充入2molY单质和8molZ单质,在一定温度下发生反应生成气体C,经40min后反应达到平衡,此时Z的转化率为37.5%。
①从反应开始到达平衡的40min内,用物质C表示的化学反应速率为 ;
②在该温度下,反应的化学平衡常数K= ;
③达到平衡后,若向容器中按1∶5∶2的物质的量比例再次充入Y、Z、C三种物质,则原平衡体系中Z的转化率将 (填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com