
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.微粒半径:S﹥S2―﹥Cl―﹥F | B.酸性:HClO4﹥H2SO4﹥H3PO4 |
| C.氧化性:Cl2﹥S﹥Se﹥Te | D.离子还原性:S2―﹥I―﹥Br―﹥OH― |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.用100mL的容量瓶准确量取100mL液体 |
| B.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出 |
| C.用托盘天平称量NaCl时,NaCl放在纸上; 称量NaOH时,NaOH放在小烧杯里 |
| D.用加热的方法提取NH4C1固体中的少量碘单质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
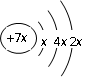 , b与c形成化合物的电子式为
, b与c形成化合物的电子式为 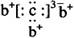 。下列比较中正确的是( )
。下列比较中正确的是( )| A.原子半径:a>c>d>b | B.电负性a>b>d>c |
| C.原子序数:d>a>c>b | D.最高价含氧酸的酸性c>d>a |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 位置是 ,Na原子结构示意图为 ,其中三种主族元素的离子半径从大到小的顺序是 (用离子符号表示)
位置是 ,Na原子结构示意图为 ,其中三种主族元素的离子半径从大到小的顺序是 (用离子符号表示)  (用离子方程式表示)。
(用离子方程式表示)。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com