
【题目】有一种水果香精乙酸正丁酯的合成提纯步骤如下:
(1)合成:在干燥的圆底烧瓶中加11.5mL(9.3g,0.125mol)正丁醇 、3~4滴浓H2SO4、7.2mL(7.5g,0.125mol)冰醋酸,摇匀后,加几粒沸石,再按图1所示装置安装好。在分水器(分离出生成的水)中预先加入5.00mL水,其水面低于分水器回流支管下沿3~5mm,然后用小火加热,反应大约40min。
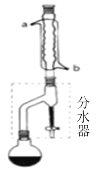
(2)分离提纯:
① 当分水器中的液面不再升高时,冷却,从分水器下端放出分水器中的水,把反应后的烧瓶中的溶液与分水器中的酯层合并,转入分液漏斗中,用10mL10%碳酸钠溶液洗至酯层无酸性(pH=7),充分震荡后静置,分去水层。
② 将酯层倒入小锥形瓶中,加少量无水硫酸镁干燥(生成MgSO47H2O晶体)。
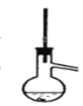
③ 将乙酸正丁酯粗产品转入50mL图中的仪器中,加几粒沸石进行加热,收集产品,主要试剂及产物的物理常数如下:
化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
密度/(g/mL) | 0.810 | 1.049 | 0.882 | 0.7689 |
沸点/℃ | 117.8 | 118.1 | 126.1 | 143 |
在水中的溶解性 | 易溶 | 易溶 | 难溶 | 难溶 |
制备过程中还可能存在的副反应有:2CH3CH2CH2CH2OH![]() CH3CH2CH2CH2OCH2CH2CH2CH3+H2O。根据以上信息回答下列问题:
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O。根据以上信息回答下列问题:
(1)写出合成乙酸正丁酯的化学方程式_________。
(2)步骤①中碳酸钠溶液的作用主要是___________,若改用NaOH溶液洗涤酯层,收集到的产物比预期少,原因是:_____________。
(3)在操作步骤②后(即酯层用无水硫酸镁干燥后),应先___________(填实验操作名称),步骤③中加热分离有机物的实验方法名称是______________。
(4)步骤③的常压蒸馏,需控制一定的温度,你认为在______中加热比较合适(请从下列选项中选择)。
A.水 B.甘油(沸点290℃) C.沙子 D.石蜡油(沸点200~300℃)
(5)反应结束后,若放出的水为6.98mL(水的密度为1g/mL),则正丁醇的转化率约为:______________。
【答案】CH3CH2CH2CH2OH+CH3COOH![]() CH3COOCH2CH2CH2CH3+H2O 除去硫酸、乙酸、正丁醇,降低酯的溶解度 产物会在氢氧化钠溶液中水解了部分 过滤 蒸馏 B、D 88%
CH3COOCH2CH2CH2CH3+H2O 除去硫酸、乙酸、正丁醇,降低酯的溶解度 产物会在氢氧化钠溶液中水解了部分 过滤 蒸馏 B、D 88%
【解析】
(1)正丁醇与冰醋酸在浓H2SO4加热条件下发生酯化反应生成乙酸正丁酯和水;
(2)乙酸正丁酯中含有乙酸、正丁醇、正丁醚和硫酸杂质,其中正丁醇、硫酸易溶于水,而乙酸正丁酯、正丁醚难溶于水,乙酸可与饱和碳酸钠反应,以此解答该题;
(3)酯层用无水硫酸镁干燥后,应过滤除去干燥剂;
(4)乙酸正丁酯的沸点是126.1℃,选择沸点稍高的液体加热;
(5)计算生成水的质量,根据方程式计算参加反应正丁醇的产量,正丁醇的利用率等于参加反应的质量与投入的总质量。
(1)正丁醇与冰醋酸在浓H2SO4加热条件下发生酯化反应生成乙酸正丁酯和水,化学方程式为CH3CH2CH2CH2OH+CH3COOH![]() CH3COOCH2CH2CH2CH3+H2O;
CH3COOCH2CH2CH2CH3+H2O;
(2)根据反应的原理和可能的副反应,乙酸正丁酯中含有乙酸、正丁醇、正丁醚和硫酸杂质,乙酸正丁酯、正丁醚不溶于饱和碳酸钠溶液,而正丁醇、硫酸易溶,乙酸可与碳酸钠反应而被吸收,可用饱和碳酸钠溶液除去乙酸正丁酯中乙酸、正丁醇和硫酸杂质;若改用NaOH溶液洗涤酯层,反应生成的酯会与NaOH发生反应,收集到的产物比预期少;
(3)酯层用无水硫酸镁干燥后,应过滤除去干燥剂;步骤③中加热分离有机物的实验方法名称是蒸馏;
(4)乙酸正丁酯的沸点是126.1℃,选择沸点稍高的液体加热,所以可以在甘油和石蜡油中选择加热的物质,水的沸点为100℃,低于乙酸正丁酯的沸点,用砂子加热温度太高不易控制且浪费能源,故选BD;
(5)反应结束后,若放出的水为6.98mL(水的密度为1g·mL-1),则反应生成的水为6.98mL-5.00mL=1.98mL,即1.98g,设参加反应的正丁醇为x,

解得x=![]() =8.14g,则则正丁醇的转化率=
=8.14g,则则正丁醇的转化率=![]() =
=![]() =88%。
=88%。


科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z、W的最外层电子数之和为16,其中X、Y、Z的电子层数相同,W原子的核外电子层数与其他三种不同,X元素的焰色反应呈黄色,Y元素能形成多种单质,其中一种单质在空气中易自燃,Z元素的最外层电子数是K层的2倍。下列推断正确的是( )
A.原子半径:X<Y
B.简单离子半径:W>X>Y
C.Z和W形成的化合物和某些酸、强碱均能发生反应
D.X、Y、W和氢元素形成的化合物的水溶液一定呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“异丙苯氧化法”生产丙酮和苯酚的合成路线如下,各反应的原子利用率均为100%。下列说法正确的是
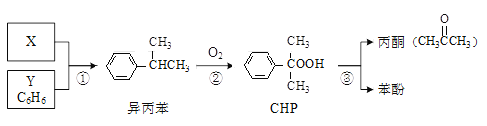
A. X的分子式为C3H8B. Y与异丙苯可用酸性KMnO4溶液鉴别
C. CHP与CH3COOH含有相同的官能团D. 可以用分液的方法分离苯酚和丙酮
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞液,在F极附近显红色.试回答以下问题:
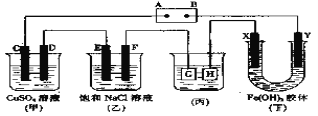
(1)电源A极的名称是_______。甲装置中电解反应的总化学方程式_____________________。
(2)如果收集乙装置中产生的气体,两种气体的体积比是______________。
(3)欲用丙装置给铜镀银,G应该是_______,电镀液的主要成分是_________(填化学式),G电极发生的反应是_____________________________。
(4)装置丁中的现象是__________________________,说明______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.NaNO3溶液中:c(Na+)=c(NO3-)
B.在Na2CO3溶液中,c(H+)=c(OH-)
C.在CH3COOH溶液中,c(CH3COOH)=c(H+)
D.K2S溶液中:2c(K+)=c(S2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.食醋常用于食品调味,其主要成分为醋酸。请回答:
(1)写出醋酸的电离方程式________________
(2)0.1mol/L醋酸溶液中加入少量盐酸,电离平衡向___反应方向移动(填“正”或“逆”)。
(3)在0.1mol/L醋酸溶液中加入少量醋酸钠晶体,晶体溶解后,醋酸溶液的pH____(选填“增大”“减小”或“不变”)。
(4)0.1mol/L醋酸溶液的pH____(选填“>”“=”或“<”)0.1mol/L盐酸溶液的pH。
(5)在0.1mol/L醋酸溶液中加入等体积等浓度的氢氧化钠溶液,反应后溶液显____性。
II.某同学想用实验确定CH3COOH是弱电解质。其方案是:
①称取一定质量的CH3COOH配制0.1molL-1的溶液100mL;
②用pH试纸测出该溶液的pH,即可证明HCOOH是弱电解质。
(1)方案的第①步中,要用到的玻璃定量仪器是______。
(2)该方案中,说明CH3COOH是弱电解质的理由是测得溶液的pH______1(选填>、<、=)。
(3)结合你所学的知识,试再提出一个简单易操作的可行方案证明CH3COOH是弱电解质(药品可任取)。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以煤为主要原料可以制备乙二醇,相关工艺流程如下:

(1)写出方法l在催化剂的条件下直接制取乙二醇的化学方程式_______
(2)合成气在不同催化剂作用下,可以合成不同的物质。下列物质仅用合成气为原料就能得到且原子利用率为100%的是_____填字母)。
A.草酸( HOOC-COOH) B.甲醇(CH3OH) C.尿素[CO(NH2)2]
(3)工业上还可以利用天然气(主要成份为CH4)与C02反应制备合成气。已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ/mol
2H2(g)+ O2(g)= 2H2O(l) △H=-571.6kJ/mol
2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol
则CH4与CO2生成合成气的热化学方程式为____________________。
(4)方法2:在恒容密闭容器中投入草酸二甲酯和H2发生如下反应:
CH3OOC—COOCH3(g)+ 4H2(g)![]() HOCH2CH2OH(g)+2CH3OH(g)△H=-34kJ/mol
HOCH2CH2OH(g)+2CH3OH(g)△H=-34kJ/mol
为提高乙二醇的产量和速率,宜采用的措施是___________(填字母)。
A.升高温度 B.增大压强 C.增大氢气浓度
(5)草酸二甲酯水解生成草酸:CH3OOC—COOCH3+ 2H2O![]() HOOC—COOH+2CH3OH
HOOC—COOH+2CH3OH
①草酸是二元弱酸,可以制备![]() (草酸氢钾),
(草酸氢钾),![]() 溶液呈酸性,用化学平衡原理解释:__________________。
溶液呈酸性,用化学平衡原理解释:__________________。
②在一定的![]() 溶液中滴加NaOH溶液至中性。下列关系一定不正确的是_______(填字母)。
溶液中滴加NaOH溶液至中性。下列关系一定不正确的是_______(填字母)。
A.![]()
B.![]()
C.![]()
(6)乙二醇、空气在KOH溶液中构成燃料电池,加入乙二醇的电极为电源的_____填“正”或“负”)极,负极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可在一定条件下进行反应:M(g)+3N(g)![]() 2P(g)+2Q(g),改变条件测得化学反应速率如下,其中能正确表示反应最快速率的是( )
2P(g)+2Q(g),改变条件测得化学反应速率如下,其中能正确表示反应最快速率的是( )
A.v(M)=0.5mol·L-1·min-1B.v(N)=1.2mol·L-1·min-1
C.v(Q)=0.4mol·L-1·min-1D.v(P)=0.1mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验事实得出的相应结论正确的是( )
选项 | 实验事实 | 结论 |
A | NH3 的水溶液可以导电 | NH3 是电解质 |
B | SO2 通入硝酸钡溶液出现白色沉淀 | BaSO3 不溶于强酸 |
C | 浓硝酸久置发黄 | 硝酸不稳定 |
D | 浓硫酸能脱去胆矾晶体中的水 | 浓硫酸具有脱水性 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com