
| A. | NaOH | B. | 漂白粉 | C. | 氯水 | D. | 生石灰 |
分析 A.易与空气中的二氧化碳反应变质;
B.先与水、二氧化碳反应生成碳酸钙和HClO而变质,然后HClO分解;
C.氯水中HClO分解而变质;
D.与水、二氧化碳反应,均没有元素的化合价变化.
解答 解:A.氢氧化钠和二氧化碳发生反应2NaOH+CO2═Na2CO3+H2O,属于非氧化还原反应,故A不选;
B.漂白粉空气中久置,先发生CO2+H2O+Ca(ClO)2═CaCO3+2HClO,属于非氧化还原反应,后发生2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,属于氧化还原反应,故B选;
C.发生2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,属于氧化还原反应,故C不选;
D.生石灰在空气中久置变质,发生CaO+H2O═Ca(OH)2,Ca(OH)2+CO2═CaCO3↓+H2O,均属于非氧化还原反应,故D不选;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握发生的反应及反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将少量SO2气体通入NaClO溶液中:2ClO-+SO2+H2O→SO32-+2HClO | |
| B. | 硫化氢气体通入硫酸亚铁溶液产生黑色硫化亚铁沉淀:H2S+Fe2+→FeS↓+2H+ | |
| C. | 向偏铝酸钠溶液中通入过量CO2:AlO2-+CO2+2H2O→Al(OH)3↓+HCO3- | |
| D. | 向硫酸铝铵[NH4Al(SO4)2]溶液中滴加足量Ba(OH)2溶液NH4++Al3++2SO42-+2Ba2++5OH-→AlO2-+2BaSO4↓+NH3•H2O+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
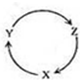 下表各组物质中,满足下右图物质一步转化关系的选项是( )
下表各组物质中,满足下右图物质一步转化关系的选项是( ) | X | Y | Z | |
| A | N2 | NO2 | NH4NO3 |
| B | Al | Al2O3 | NaAlO2 |
| C | Cu | CuO | CuCl2 |
| D | Si | SiO2 | H2SiO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol SO2和足量的O2反应,必定生成2mol SO3 | |
| B. | 当v(正)>V(逆)时,随着反应的进行,反应物的物质的量逐渐减小 | |
| C. | 正反应速率之比为v(SO2):v(O2):v(SO3)=2:1:2时,反应达到平衡 | |
| D. | 反应达到平衡后,升高温度,平衡不一定发生移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2具有漂白性 | B. | SO2为酸性氧化物 | C. | SO2具有还原性 | D. | SO2具有氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com