

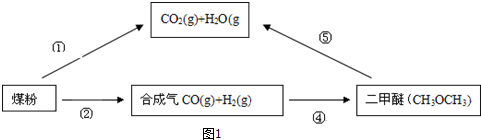
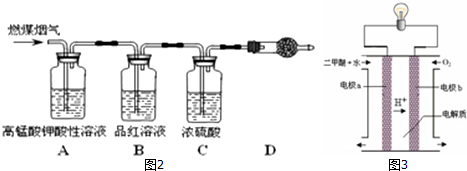
分析 (1)A装置中过氧化氢在二氧化锰催化作用下制备氧气,B用于干燥氧气,在C中样品被氧化生成水和二氧化碳,D用于吸收水,测定生成水的质量,E用于吸收二氧化碳,测定生成二氧化碳的质量;
(2)计算X、水、二氧化碳的物质的量,根据原子守恒计算式分子中C、H原子数目,结合相对分子质量计算分子中O原子数目,进而确定X的分子式;
CuO的作用是把有机物不完全燃烧产生的CO转化为CO2.
解答 解:A装置中过氧化氢在二氧化锰催化作用下制备氧气,B用于干燥氧气,在C中样品被氧化生成水和二氧化碳,D用于吸收水,测定生成水的质量,E用于吸收二氧化碳,测定生成二氧化碳的质量.
(1)b为分液漏斗,B中浓硫酸的作用是干燥氧气,A为过氧化氢在二氧化锰催化作用下制备氧气,反应方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,
故答案为:分液漏斗;干燥氧气;2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;分液漏斗;
(2)6.2gX的物质的量为$\frac{6.2g}{62g/mol}$=0.1mol,D装置增重5.4g,为水的质量,n(H2O)=$\frac{5.4g}{18g/mol}$=0.3mol,
E装置增重8.8g,为二氧化碳的质量,且n(CO2)=$\frac{8.8g}{44g/mol}$=0.2mol,
故X分子中N(C)=$\frac{0.2mol}{0.1mol}$=2、N(H)=$\frac{0.3mol×2}{0.1mol}$=6,则N(O)=$\frac{62-12×2-6}{16}$=2,所以X的分子式为C2H6O2,
CuO的作用是把有机物不完全燃烧产生的CO转化为CO2,若将CuO网去掉,E中增加的质量将减小,
故答案为:C2H6O2;减小.
点评 本题考查探究物质组成的实验,题目难度中等,明确实验原理为解答关键,试题侧重考查有机物分子式、结构简式的确定,注意掌握质量守恒定律在确定有机物分子式中的应用方法,试题培养了学生的分析、理解能力及化学实验能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.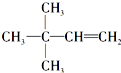 等.
等.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
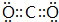 ;C 单质在高温下与B单质充分反应所得化合物的电子式为
;C 单质在高温下与B单质充分反应所得化合物的电子式为 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.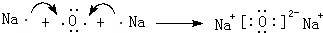 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯元素在自然界中存在游离态,只是量极少 | |
| B. | 海水中的氯元素主要以NaCl等盐的形式存在 | |
| C. | 人体血液中含有NaCl,其浓度大约为0.9% | |
| D. | NaCl对维持人体的生理功能有着重要作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com