
【题目】将固体NH4Br置于2.0 L的密闭容器中,在某温度下发生如下反应:
NH4Br(s)![]() NH3(g)+HBr(g)
NH3(g)+HBr(g)
2HBr(g)![]() Br2(g)+H2(g)
Br2(g)+H2(g)
2 min后,测得H2为1 mol,HBr为8 mol,则上述反应中生成NH3的速率为( )
A. 0.5 mol·(L·min)-1 B. 2 mol·(L·min)-1
C. 2.5 mol·(L·min)-1 D. 5 mol·(L·min)-1
【答案】C
【解析】
溴化铵分解生成的溴化氢又有一部分分解,故剩余的溴化氢的量为溴化铵分解生成的溴化氢的量减去分解的溴化氢的量,据此分析;氢气的物质的量为1mol,其浓度=1/2=0.5mol/L,据此计算分解的溴化氢的浓度;
此题为连锁反应,溴化铵分解生成的溴化氢又有一部分分解,故剩余的溴化氢的量为溴化铵分解生成的溴化氢的量减去分解的溴化氢的量,即c剩余(HBr)=c生成(HBr)-c分解(HBr);氢气的物质的量为1mol,其浓度=1/2=0.5mol/L,则c分解(HBr)=1mol/L;HBr的物质的量为8mol,c剩余(HBr)=8/2=4mol/L;则c生成(HBr)=c分解(HBr)+c剩余(HBr)=1mol/L+4mol/L=5mol/L;溴化铵分解生成的氨气浓度与溴化氢浓度相等,则2min后溴化铵分解生成的氨气的浓度为:c(NH3)=c生成(HBr)=5mol/L,氨气的平均反应速率为:v=5/2==2.5mol/(Lmin);C正确;
综上所述,本题选C。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】(1)填空
①除去硝酸钾中混有的少量氯化钠,操作步骤为:制成热饱和溶液、_______、过滤;
②分离四氯化碳和水的操作名称为_________;
③除去氢气中氯化氢的操作名称为 ________;
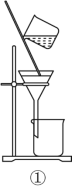
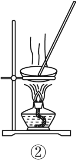
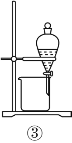
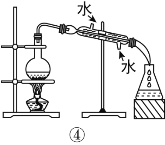
(2)从如图装置中选择
![]()
①除去水中的氯离子,所需装置序号为_______;
②除去铜粉中的锌粉,所需装置序号为 _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用如图装置对电解质溶液导电性进行实验探究。下列说法中正确的是( )
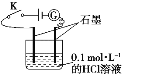
A. 闭合开关K,电流计指针发生偏转,证明HCl溶液是电解质
B. 闭合开关K,向烧杯中加入NaCl固体,由于HCl与NaCl不反应,故电流计指针不发生变化
C. 闭合开关K,向溶液中加入CaCO3固体,电流计示数不变
D. 选取相同浓度的硫酸替换0.1 mol·L-1的HCl溶液,电流计的示数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组进行如下实验
Ⅰ.探究反应速率的影响因素
设计了如下的方案并记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20 mol·L-1H2C2O4 溶液、0.010 mol·L-1KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
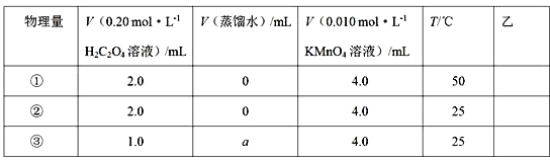
(1)上述实验①、②是探究_____对化学反应速率的影响;若上述实验②、③是探究浓度对化学反应速率的影响,则 a 为_________;乙是实验需要测量的物理量,则表格中“乙”应填写_____。
Ⅱ.测定 H2C2O4·xH2O 中 x 值
已知:M(H2C2O4 )=90 g·mol-1
① 称取 1.260 g 纯草酸晶体,将草酸制成 100.00 mL 水溶液为待测液;
② 取 25.00 mL 待测液放入锥形瓶中,再加入适量的稀 H2SO4;
③ 用浓度为 0.05 000 mol·L-1 的 KMnO4标准溶液进行滴定。
(2)请写出滴定中发生反应的离子方程式_____。
(3)某学生的滴定方式(夹持部分略去)如下,最合理的是_____(选填 a、b)。
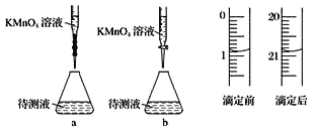
(4)由图可知消耗 KMnO4 溶液体积为_____mL。
(5)滴定过程中眼睛应注视_________,滴定终点锥形瓶内溶液的颜色变化为_____。
(6)通过上述数据,求得 x=_____。若由于操作不当,滴定结束后滴定管尖嘴处有一气泡, 引起实验结果_____(偏大、偏小或没有影响);其它操作均正确,滴定前未用标准 KMnO4 溶液润洗滴定管,引起实验结果_________(偏大、偏小或没有影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置完成对应的实验,能达到实验目的的是
A. 制取并收集少量氨气 
B. 比较NaHCO3和Na2CO3的热稳定性
C. 制取并检验乙烯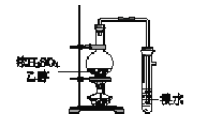
D. 比较盐酸、碳酸、硅酸的酸性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是
①C(s) + H2O(g)==CO(g)+H2(g) ΔH1=a kJmol-1
②CO(g) + H2O(g)==CO2(g)+H2(g) ΔH2=b kJmol-1
③CO2(g)+3H2(g)==CH3OH(g)+H2O(g) ΔH3 =c kJmol-1
④2CH3OH(g) ==CH3OCH3(g)+H2O(g) ΔH4=d kJmol-1
A. 反应①②为反应③提供原料气
B. 反应③也是CO2资源化利用的方法之一
C. 反应CH3OH(g)== ![]() CH3OCH3(g)+
CH3OCH3(g)+ ![]() H2O(1)的ΔH =
H2O(1)的ΔH =![]() kJmol-1
kJmol-1
D. 反应 2CO(g)+4H2(g) ==CH3OCH3(g)+H2O(g)的ΔH= (2b+2c+d) kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A 气体和2 mol B 气体在2 L的容器中混合并在一定条件下发生反应:2A(g)+B(g) ![]() 2C(g)。若2s末测得C的浓度为 0.6 mol·L-1,现有下列几种说法:
2C(g)。若2s末测得C的浓度为 0.6 mol·L-1,现有下列几种说法:
①2s内,用物质A表示的反应的平均速率为0.6 mol·L-1·s-1;
②2s末,体系中混合气体的压强是起始的0.9倍;
③2 s末,物质A的转化率为30 %;
④2 s末,物质C的体积分数约为22.2%。
⑤2s内,分别用A、B、C表示的反应速率其比值是14:7:6
其中正确的是
A. ①④⑤ B. ②③④ C. ①③④ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)是具有紫色光泽的粉末,是一种高效绿色强氧化剂,碱性条件下稳定,可用于废水和生活用水的处理。实验室以石墨和铁钉为电极,以不同浓度的NaOH溶液为电解质溶液,控制一定电压电解制备高铁酸钠,电解装置和现象如下:
c(NaOH) | 阴极现象 | 阳极现象 |
1 mol·L-1 | 产生无色气体 | 产生无色气体,10min内溶液颜色无明显变化 |
10 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,3min后溶液变为浅紫红色,随后逐渐加深 |
15 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,1min后溶液变为浅紫红色,随后逐渐加深 |
下列说法不正确的是

A. a为铁钉,b为石墨
B. 阴极主要发生反应:2H2O + 2e-=== H2↑+ 2OH-
C. 高浓度的NaOH溶液,有利于发生Fe-6e-+ 8OH-=== FeO42-+ 4H2O
D. 制备Na2FeO4时,若用饱和NaCl溶液,可有效避免阳极产生气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、H、N这三种化学元素在组成人体的化学成分中,质量分数共占73%(占细胞干重)左右,而这三种元素在岩石圈中,其质量分数还不到1%。这个事实说明( )
A.生物界与非生物界具有统一性B.生物界与非生物界具有差异性
C.元素在自然界中都可以找到D.生物界具有特殊性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com