
| A. | Ca2+、Na+、CO32- | B. | Na+、Ca2+、HCO3- | C. | K+、Na+、NO3-. | D. | NH4+、SO42-、Cu2+ |
分析 A.钙离子与碳酸根离子反应生成难溶物碳酸钙沉淀;
B.碳酸氢根离子、钙离子与强碱性溶液反应生成碳酸钙沉淀;
C.三种离子之间不反应,都不与氢氧根离子反应;
D.铵根离子、铜离子与强碱性溶液反应.
解答 解:A.Ca2+、CO32-之间反应生成难溶物碳酸钙,在溶液中不能大量共存,故A错误;
B.Ca2+、HCO3-与强碱性溶液反应生成碳酸钙,在溶液中不能大量共存,故B错误;
C.K+、Na+、NO3-之间不发生反应,都不与强碱性溶液中的氢氧根离子反应,在溶液中能够大量共存,故C正确;
D.NH4+、Cu2+都与强碱性溶液中的氢氧根离子反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识解决实际问题的能力.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:解答题
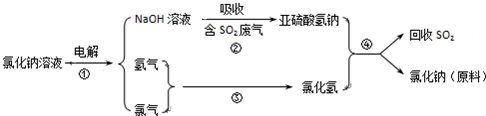
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
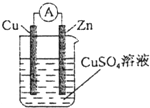
| A. | 铜棒为正极 | B. | 锌棒发生氧化反应 | ||
| C. | 电流从铜棒经外电路流向锌棒 | D. | 锌棒质量增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气易液化 | |
| B. | 氨水呈碱性 | |
| C. | 氨气极易溶于水,使烧瓶内外形成压强差 | |
| D. | 氨气溶于水后形成的溶液易挥发 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红热的铜丝在氯气中燃烧,产生棕黄色的烟 | |
| B. | 碘水中加入少量汽油振荡,静置后上层颜色变浅,下层颜色变为紫色 | |
| C. | 往溴水中加入碘化钠溶液,溴水变为无色 | |
| D. | 氢气在Cl2中燃烧产生苍白色的烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2溶液 | B. | NaOH溶液 | C. | Ba(OH)2溶液 | D. | AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,反应类型加聚反应.
,反应类型加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
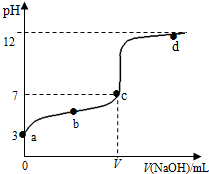 在常温下向20mL 0.1mol•L-1 某酸(用HA表示)溶液中逐滴加入0.1mol•L-1 NaOH溶液,用pH计来测定溶液中pH数据如下表,作出pH与NaOH溶液体积关系的曲线如图所示(忽略温度变化).请根据表中数据和滴定曲线回答以下问题:
在常温下向20mL 0.1mol•L-1 某酸(用HA表示)溶液中逐滴加入0.1mol•L-1 NaOH溶液,用pH计来测定溶液中pH数据如下表,作出pH与NaOH溶液体积关系的曲线如图所示(忽略温度变化).请根据表中数据和滴定曲线回答以下问题:| V(NaOH)mL | 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 | 40.00 |
| pH | 3.0 | 4.7 | 5.7 | 6.7 | 7.7 | 8.7 | 9.7 | 10.7 | 11.7 | 12.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com