
常温下,在BaSO4饱和溶液中加入Na2SO4固体,达到溶解平衡时,下列说法正确的是
A.c (Ba2+) = c (SO42-)
B.c (Ba2+) 增大,c (SO42-) 减小
C.c (Ba2+) ≠ c (SO42-),c (Ba2+)·c (SO42-) = KSP (BaSO4)
D.c (Ba2+) ≠ c (SO42-),c (Ba2+)·c (SO42-) ≠ KSP (BaSO4)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年福建三明一中高一上学期第二次月考化学卷(解析版) 题型:选择题
下列各组离子能在某无色溶液中大量共存的是
A.HSO3-、H+、MnO4-、K+ B.Cl-、NO3-、Fe2+、H+
C.Ba2+、OH-、Cl-、 Na+ D.NH4+、Na+、NO3-、OH-
Na+ D.NH4+、Na+、NO3-、OH-
查看答案和解析>>
科目:高中化学 来源:2016届云南师大附属中学高三上适应性月考理综化学试卷(解析版) 题型:填空题
【化学—选修3:物质结构与性质】
在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物
(1)氨气是共价型氢化物。工业常用氨气和醋酸二氨合铜{[Cu(NH3)2]Ac}的混合液来吸收一氧化碳(醋酸根CH3COO?简写为Ac?)。反应方程式为:[Cu(NH3)2]Ac+ CO+NH3 [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
①请写出基态Cu原子的电子排布式 。
②氨水溶液中各元素原子的第一电离能从大到小排列顺序为 ,理由是 ;其中NH3应为 (填“极性”或“非极性”)分子。
③醋酸分子中的两个碳原子的化方式分别是 。
④生成物[Cu(NH3)3CO]Ac中所含化学键类型有 。(填序号)
a.离子键 b.金属键 c. 共价键 d. 配位键
(2)某离子型氢化物化学式为XY2,晶胞结构如下图所示,其中6个Y原子(○)用阿拉伯数字1~6标注。
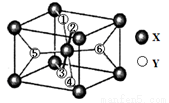
①已知1、2、3、4号Y原子在晶胞上、下面上。则5、6号Y原子均在晶胞 。(填“侧面”或“内部”)
②根据以上信息可以推知,XY2晶体的熔沸点 (填“>”“=”“<”)固态氨的沸点。
③若该晶胞的边长为a nm,密度为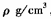 ,XY2的摩尔质量为
,XY2的摩尔质量为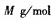 ,则阿伏加德罗常数可表示为
,则阿伏加德罗常数可表示为
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上11月月考化学试卷(解析版) 题型:选择题
化学已深入我们的生活,下列说法不正确的是
A.醋酸可除水垢
B.甘油可做护肤保湿剂
C.包装用的聚氯乙烯属于烃
D.酯类物质是形成水果香味的主要成分
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二上12月月考化学试卷(解析版) 题型:填空题
某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料:(以下数据和实验均指在25℃下测定)
难溶电解质 | CaCO3 | CaSO4 |
Ksp | 2.8×10-9 | 9×10-6 |
实验步骤如下:
①往100 mL 0.1 mol·L-1的CaCl2溶液中加入100 mL 0.1 mol·L-1的Na2SO4溶液,立即有白色沉淀生成。
②向上述悬浊液中加入足量Na2CO3 固体,搅拌,静置,沉淀后弃去上层清液.
③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液.
④________________________。
(1)步骤①所得悬浊液中c(Ca2+)=________ mol·L-1
(2)写出第②步发生反应的离子方程式:_______________________
(3)请补充第④步操作及发生的现象___________________________
(4)请写出该原理在实际生产生活中的一个应用________________________
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一上12月月考化学试卷(解析版) 题型:选择题
下列物质既能与酸反应又能与碱反应的是
A.MgO B.AlCl3 C.KAlO2 D.NaHCO3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高二上期中测试化学试卷(解析版) 题型:选择题
下列事实中,与电化学腐蚀无关的是
A.用于连接铜板的铁螺丝容易生锈
B.在铁中加入铬等特殊金属形成不锈钢
C.大型水闸常与直流电源的负极相连,再在电极的正极连上惰性电极,置于水中
D.为保护海轮的船壳,常在船壳上镶入锌块
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北航天高中、安陆二中等五校高二上期中化学试卷(解析版) 题型:选择题
已知下列热化学方程式:
①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H1=﹣26.7kJ•mol﹣1
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H2=﹣50.75kJ•mol﹣1
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H3=﹣36.5kJ•mol﹣1
则反应FeO(s)+CO(g)═Fe(s)+CO2(g)的焓变为( )
A.+7.28kJ/mol B.-7.28kJ/mol C.+43.68kJ/mol D.-43.68kJ/mol
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一上学期期中测试化学试卷(解析版) 题型:选择题
条件相同的理想气体,决定其所占体积大小的主要因素是
A.分子直径的大小 B.分子间距离的大小
C.组成分子的原子个数 D.分子数目的多少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com