
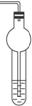
操作步骤:(1)如图装置Ⅰ所示,组装好实验装置。
(2)加入乙醇、乙酸及浓硫酸,点燃酒精灯缓慢加热。
(3)将产生的蒸气经导管导入装置A中,观察现象。
回答下列问题:
(1)请写出该反应的反应方程式:____________________。
(2)某同学在做实验时,为防止倒吸,对A装置进行的改进,请在右边虚框中画出改进部分装置图。
(3)若该同学用
①反应过程中升温过快过高,从而使一部分反应物未来得及充分反应
②该反应为可逆反应,反应不能进行彻底
③生成的乙酸乙酯未能充分冷凝下来
(4)为了提高反应物的利用率,另一同学认为采用了装置Ⅱ,你认为有何优点?__________________。
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2010?祁阳县一模)某校化学研究性学习小组为探究铜及其化合物的性质,进行了如下科学探究:
(2010?祁阳县一模)某校化学研究性学习小组为探究铜及其化合物的性质,进行了如下科学探究:| 物质 | 性质 | 物质 | 性质 |
| 氯化铜 | 浓溶液呈绿色,稀溶液呈蓝色 | 氯化亚铜 | 白色 |
| 氧化亚铜 | 砖红色,在酸性条件下易反应: Cu2O+2H+=Cu+Cu2++H2O. Cu2O在空气中灼烧生成CuO |
氢氧化亚铜 | 橙黄色,不稳定 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
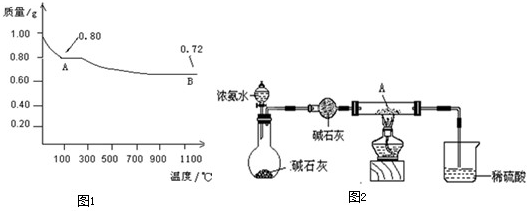
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com