
[化学——选修3:物质结构与性质](15分)
硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为____ ,该能层具有的原子轨道数为____ 、电子数为 。
(2)硅主要以硅酸盐、____ 等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以 相结合,其晶胞中共有8个原子,其中在面心位置贡献____ 个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4C1在液氨介质中反应制得SiH4,该反应的化学方程式为___ 。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是 。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是____ 。
(6)在硅酸盐中,SiO44-四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为 。Si与O的原子数之比为 。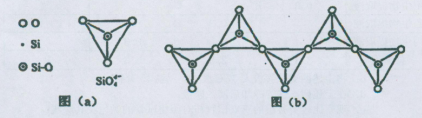
(1)M 9 4
(2)二氧化硅
(3)共价键 3
(4)Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2
(5)①C—C键和C—H键较强,所形成的烷烃稳定。而硅烷中Si—Si键和Si—H键的键能较低,易断裂。导致长链硅烷难形成。
②C—H键的键能大于C—O键,C—H键比C—O键稳定。而,Si—H键的键能远小于Si—O键,所以Si—H键不稳定而倾向于形成稳定性更强的Si—O键
(6)sp3 1:3 SiO32-
解析试题分析:⑴根据硅的原子序数为14,其基态原子的电子排布式为1s22s22p63s23p2,则电子占据的最高能层符号为M(第三层),该能层具有的原子轨道数为9,电子数为4。
⑵硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中。
⑶单质硅属于原子晶体,其中原子与原子之间以共价键相结合,其晶胞中共有8个原子,有6个位于面心,故在面心位置贡献3个原子。
⑷Mg2Si和NH4C1反应制备SiH4,据原子守恒生成物还有NH3和MgCl2,最后根据观察法将其配平。
⑸①由于非金属性C>Si,又据表中C-C键和C-H键的键能比Si-Si 、Si-H的键能大,故形成的烷烃比硅烷稳定,同时也导致长链硅烷难以生成,故硅烷在种类和数量上都远不如烷烃多。
②由于C-H键的键能大于C-O键,说明C-H键比C-O键稳定,而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定更倾向于生成更稳定的Si-O键,故SiH4的稳定性小于CH4,更易生成氧化物。
⑹根据“SiO44-的四面体”结构,可知其Si原子的杂化形式为sp3;Si与O的原子数之比为1:(2+2×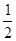 )=1:3(注意:每个结构单元中有2个氧原子与其它2个结构单元共用)。
)=1:3(注意:每个结构单元中有2个氧原子与其它2个结构单元共用)。
考点:考查核外电子的排布原理、晶体中原子数的计算、键能与分子稳定性的分析判断等


科目:高中化学 来源: 题型:单选题
下表实验中“操作及现象”与“给定溶液”的性质不对应的是
| 选项 | 溶液 | 操作及现象 |
| A | Ca(OH)2溶液 | 通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失。再加入足量NaOH溶液,又变浑浊。 |
| B | 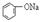 溶液 溶液 | 通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失。 |
| C | Ca(ClO)2溶液 | 通入CO2,溶液没有明显变化。再滴入品红溶液,红色褪去。 |
| D | CaCl2溶液 | 通入CO2,溶液没有明显变化。若同时通入CO2和NH3,则溶液变浑浊。 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关硅及其化合物的说法正确的是
| A.单质硅常用作半导体和光导纤维材料 |
| B.硅在自然界中只以化合态的形式存在 |
| C.SiO2与纯碱高温生成CO2,说明硅酸的酸性比碳酸强 |
| D.SiO2是非金属氧化物,它不与任何酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分) 某学生设计了一套验证物质化学性质的实验装置(如图):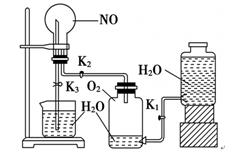
请观察该装置图,完成下列问题:
(1)该实验的目的是
(2)该实验的涉及的化学方程式有
(3)实验用品:实验仪器除铁架台(带铁夹)、储气瓶(两个)、直管活塞(K1、K2)、止水夹(K3)、橡胶管、橡胶塞以及若干玻璃管连件外,还有哪几种(写仪器名称) ____________________。
(4)实验步骤:①按上图连接好仪器装置;②扭开活塞K1和K2,主要现象为 ;
③关闭 ,(填写K1或K2或K3)打开 ,(填写K1或K2或K3), 用手或热毛巾捂住圆底烧瓶,就能使烧瓶产生喷泉。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(6分)请从下图中选出必要的装置进行电解饱和食盐水的实验,要求测定产生的H2的体积(大于25 mL),并检验Cl2的氧化性。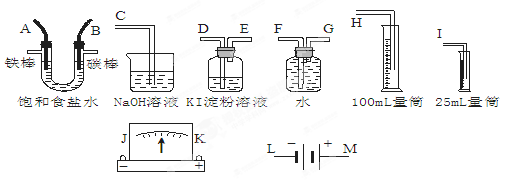
(1)A极发生的电极反应式是______________,B极发生的电极反应式是_____________。
(2)设计上述气体实验装置时,各接口的正确连接顺序为:______接______、______接A、B接______、______接______。(填气体接口字母)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(本题共12分)
硫在自然界中以游离态和多种化合态形成出现。硫的化合物大多具有氧化性或还原性。许多金属硫化物难溶于水。
完成下列填空:
(1)硫化氢具有还原性,可以和许多氧化剂反应。在酸性条件下,H2S和KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式。_________________________________
(2)石油化工的废气中有H2S。写出从废气中回收单质硫的两种方法(除空气外,不使用其他原料),以化学方程式表示。_____________________、______________________
(3)室温下,0.1mol/L的硫化钠溶液和0.1mol.L的碳酸钠溶液,碱性更强的是_______,其原因是________。
已知:H2S:Ki1=1.3×10-7 Ki2=7.1×10-15
H2CO3:Ki1=4.3×10-7 Ki2=5.6×10-11
(4)向ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,继续滴加一定量的氨水后,生成ZnS沉淀。用电离平衡原理解释上述现象。__________________________
(5)将黑色的Fe2S3固体加入足量盐酸中,溶液中有淡黄色固体生成,产物还有____、______。过滤,微热滤液,然后加入过量的氢氧化钠溶液,可观察到的现象是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
[化学—选修2:化学与技术](15分)
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到硫酸,如橡胶的硫化、表面活性剂“烷基苯硫酸钠”的合成,铅蓄电池的生产等。工业上生产硫酸的流程图如下: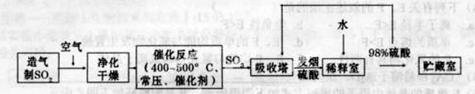

请回答下列问题
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,已知1g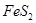 完全燃烧放出7.2kJ的热量
完全燃烧放出7.2kJ的热量 燃烧反应的热化学方程式_______ ______。
燃烧反应的热化学方程式_______ ______。
(2)为了有利于SO2转化为SO3,且能充分利用热能,采用在具有多层催化剂且又热交换的________(填仪器名称)中进行反应。在如图Ⅰ所示的装置中, A处气体进入装置前需净化的原因是 。
(3)精制炉气(含有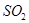 体积分数为7%、O2为11%、N2为82%)中
体积分数为7%、O2为11%、N2为82%)中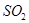 平衡 转化率与温度及压强关系如图2所示、在实际生产中,
平衡 转化率与温度及压强关系如图2所示、在实际生产中,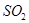 催化氧化反应的条件选择常压、
催化氧化反应的条件选择常压、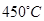 左右(对应图中A点):而没有选择
左右(对应图中A点):而没有选择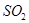 转化率更高的B或C点对应的反应条件,其原因分别是: 、 。
转化率更高的B或C点对应的反应条件,其原因分别是: 、 。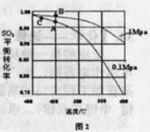
(4)已知:焙烧明矾的化学方程式4KAl(SO4)2?12H2O+3S═2K2SO4+2Al2O3+9SO2+48H2O。
焙烧711t明矾(M=474g/mol),若 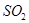 的利用率为95%,可生产质量分数为98%的硫酸 t。(结果保留小数点后一位)
的利用率为95%,可生产质量分数为98%的硫酸 t。(结果保留小数点后一位)
(5)除硫酸工业外,还有许多工业生产。下列相关的工业生产流程中正确的是
| A.向装置中通入氮气且保持体积不变 |
| B.向装置中通入氧气且保持体积不变 |
| C.添加更多的催化剂 |
| D.降低温度,及时转移SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
研究CO、SO2、NO等大气污染气体的综合处理与利用具有重要意义。
(1)以CO或CO2与H2为原料,在一定条件下均可合成甲醇,你认为用哪种合成设计线路更符合“绿色化学”理念:(用化学反应方程式表示) 。
(2)如图所示是用于合成甲醇产品中甲醇含量的检测仪。写出该仪器工作时的电极反应式: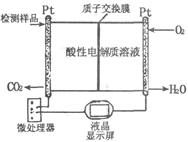
负极 ,正极 。
(3)一定条件下,NO2和SO2反应生成SO3(g)和NO两种气体,现将体积比为1:2的NO2和SO2的混合气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。(填序号)
| A.体系压强保持不变 | B.混合气体颜色保持不变 |
| C.SO3、NO的体积比保持不变 | D.每消耗 1 mol SO2,同时生成1 mol NO |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在制玻璃的原料中,再加入下列物质后,可制得各种不同用途的玻璃:
| A.氧化亚铜(Cu2O) | B.氧化钴(Co2O3) |
| C.氧化铅(PbO) | D.硼砂(Na2B4O7·10H2O) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com