
. 图中A-J均为有机化合物,根据图中的信息,回答下列问题:
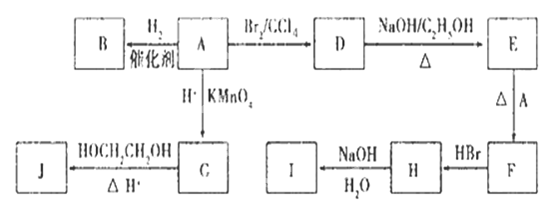
(1)环状化合物A的相对分子质量为82,其中含碳87. 80%,含氢12. 20%。B的一氯代物仅有一种,B的结构简式为 ;
(2)M是B的一种同分异构体,M能使溴的四氯化碳溶液褪色,分子中所有的碳原子共平面,则M的结构简式为 ;
(3)由A生成D的反应类型是___________,由D生成E的反应类型是_______ _____;
(4)(3分)C的分子式为C6H10O4,0.146 g G需用20 mL0.100 mol/L NaOH溶液完全中和,J是一种高分子化合物。则由G转化为J的化学方程式为:
_______ ___
(5)H中含有的官能团是(名称)________,I中含有的官能团是(名称)___________。
科目:高中化学 来源: 题型:
下列各类物质依次表示为X、Y、Z ,其中与图1三个圆所示的从属关系不相符的是
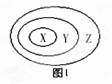 A.置换反应、氧化还原反应、化学反应
A.置换反应、氧化还原反应、化学反应
B. NaOH、电解质、化合物
C. 胶体、溶液、混合物
D.Fe2O3、金属氧化物、氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是: ( )
A.维生素C具有还原性,在人体内起抗氧化作用
B.为防止月饼等富脂食品氧化变质,常在包装袋中放入硫酸亚铁
C.由水电离出来的c(H+) = 1×10-13 mol/L的溶液中:K+、CO32-、Cl-、NO3-可能大量共存
D.使石蕊变红的溶液中: Na+、I-、Cl-、NO3-可能大量共存
查看答案和解析>>
科目:高中化学 来源: 题型:
运用相关化学知识进行判断,下列结论错误的是 ( )
A.某吸热反应能自发进行,因此该反应是熵增反应
B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中
C.可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底
D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:① Fe2O3(s)+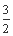 C(s)
C(s)
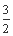 CO2(g)+2Fe(s) ΔH=+234.1 kJ·mol-1
CO2(g)+2Fe(s) ΔH=+234.1 kJ·mol-1
②C(s)+O2(g) CO2(g) ΔH=-393.5 kJ·mol-1
CO2(g) ΔH=-393.5 kJ·mol-1
则Fe(s)与O2反应生成Fe2O3的热化学方程式是
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗
B.将含硫酸的废液倒入水槽,用水冲入下水道
C.用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干
D.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶支管口处
查看答案和解析>>
科目:高中化学 来源: 题型:
对下列实验现象的描述错误的是
A.将NaOH溶液加到FeSO4溶液中,生成的沉淀颜色变化:白色→灰绿色→红褐色
B.Cu加到稀H2SO4中,生成无色气体
C.金属Na投入滴有酚酞的水中,得到的溶液颜色变化:无色→红色
D.将NaOH溶液加到AlCl3溶液中,实验现象为:先生成白色沉淀后逐渐溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列给定条件的各溶液中,一定能大量共存的离子组是( )
A.含有0.1 mol·L-1 Fe3+的溶液中:K+、Mg2+、SCN-、NO3-
B.室温下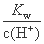 =10-13 mol·L-1的溶液中:NH4+、Mg2+、NO3-、SO42-
=10-13 mol·L-1的溶液中:NH4+、Mg2+、NO3-、SO42-
C.加入Al能放出H2的溶液中:NH4+、K+、Cl-、HCO3-
D.在H+、Na+、SO42-浓度均为0.1 mol·L-1的溶液中:K+、SiO32-、Cl-、CH3COO-
查看答案和解析>>
科目:高中化学 来源: 题型:
镁是一种重要的金属资源,工业上制取镁单质主要是电解法。
(1)电解法制取镁单质的反应方程式是:______________________________。
(2)电解原料无水氯化镁可由海水制备。主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩冷却结晶。
其步骤先后顺序是__________________________________;(每步骤可重复使用)
(3)上述步骤①中“一定条件下”具体是指:_______________________________,其目的是___________________________________________。
(4)已知某温度下Mg(OH)2的Ksp=6.4×l0−12,当溶液中c(Mg2+)≤1.0×10−5mol·L−1可视为沉淀完全,则此温度下应保持溶液中c(OH-)≥_________________ mol·L−1。
(5)饱和NH4Cl溶液滴入少量的Mg(OH)2悬浊液中,看到的现象是___________。反应原理可能有两方面,请分别用离子方程式表示:
①________________________________________________;
②________________________________________________。
要验证①②谁是Mg(OH)2溶解的主要原因,可选取________代替NH4Cl溶液作对照实验。
A.NH4NO3 B.(NH4)2SO4 C.CH3COONH4 D.NH4HCO3
(6)镁电池是近年来科学技术研究的热点之一。一种“镁—次氯酸盐”电池的总反应为:
Mg + ClO- + H2O == Mg(OH)2 + Cl- 。其工作时正极的电极反应式:_________________;用此镁电池给铅蓄电池充电,下列说法中正确的是______________________________。
A.镁电池正极与铅蓄电池正极相连
B.电子从Pb电极转移到镁电池负极
C.充电后,铅蓄电池两极质量均减小,理论上镁电池消耗24 g Mg,阴、阳极的质量变化之比为3︰2
D.充电后,镁电池和铅蓄电池的pH均增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com