
| ѡ�� | Ŀ �� | ���������� |
| A | �Ʊ���ˮFeCl3 | ��FeCl3��Һ�������� |
| B | ��ȥKNO3������NaCl | ��������Ƴ��ȵı�����Һ����ȴ�ᾧ������ |
| C | ֤���ǽ�����Cl��C��Si | ��̼������Һ�м�����������壬��������ͨ������NaHCO3��Һ����ͨ���������Һʱ������ɫ���� |
| D | �ⶨNaCl�л���Na2CO3���� | ȡһ������Ʒ��������ϡ���ᣬ������������ֱ����������ʯ�����գ���������أ�������ԭ��Ʒ��Na2CO3���� |
| A�� | A | B�� | B | C�� | C | D�� | D |
���� A�����ȴٽ�ˮ�⣬���ɵ�HCl�ӷ���
B�����ߵ��ܽ�����¶�Ӱ�첻ͬ��
C����������HCl��̼������ԱȽϷǽ����ԣ�
D��ֱ����������ʯ�����գ�����Ϊˮ�Ͷ�����̼��������
��� �⣺A���Ȼ�����Һ�д���ˮ��ƽ�⣬���������Ȼ�����Һ��Fe3++3H2O?Fe��OH��3+3H+��ˮ�����ɵ��Ȼ���ӷ������ɵõ�ˮ�����������������A����
B��KNO3��ˮ���ܽ�Ƚϴ�NaCl��ˮ�е��ܽ�Ȳ����������ܽ�Ȳ��������ȴ�ᾧ�ķ�����ȥNaCl���ʣ���B��ȷ��
C��֤��Ԫ�طǽ�����ǿ�������ݣ�Ԫ������������Ӧˮ������������Խǿ�����Ԫ�صķǽ�����Խǿ�����ܿ�������̼���������Դ�С��Ӧ���ø�������̼���������Դ�С�Ƚϣ���C����
D��ȡһ������Ʒ��������ϡ���ᣬ������������Ҫ�Ƕ�����̼���������к���һ����ˮ�֣�Ӧ���Ƚ��и��������������ʯ�����գ���������أ�������ԭ��Ʒ��Na2CO3��������D����
��ѡB��
���� ���⿼�黯ѧʵ�鷽�������ۣ�Ϊ��Ƶ���㣬�漰����ˮ�⡢���������ᴿ���ǽ����Ժ����ԱȽϡ������ⶨ�ȣ��������ʵ����ʡ���Ӧԭ��Ϊ���Ĺؼ������ط�����ʵ�������Ŀ��飬ע��ʵ�������Է�������Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��̬�⻯����ȶ��ԣ�HCl��HBr��HI | B�� | ���Ӱ뾶��S2-��Na+��O2- | ||
| C�� | ���ԣ�HClO4��H2SO4��H3PO4 | D�� | �۵㣺SiO2��NaCl���ɱ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ۡ���ά������ˮ������Ϊ���� | |
| B�� | ����������ˮ������Ƕ��� | |
| C�� | ���ǡ���ѿ��ˮ�������ͬ | |
| D�� | ����ǿ��������ˮ�����ɶ�Ӧ����ʹ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ʵ����� | ���� | ���� |
| A | պ��Ũ��ˮ�IJ���������ij��Һ | �а��̲��� | ����Һ������Ũ���� |
| B | ��SO2ͨ��Ba��NO3��2��Һ | ������ɫ���� | SO2������Ա��ξ������ɰ�ɫ���� |
| C | ��Zn��ϡ���ᷴӦ����Һ�еμ�����ͭ��Һ | ������������ʼӿ� | ����ͭ���÷�Ӧ�Ĵ��� |
| D | �ò�˿պȡ����ij��Һ������ɫ��Ӧ | ����ʻ�ɫ | ����Һһ����������Һ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
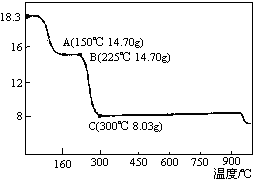 ���������Ʊ��ܵ����������Ҫԭ�ϣ���ͼΪ��ˮ�ϲ����ܣ�CoC2O4•2H2O���ڿ��������ȵ������仯���ߣ�������300�漰�������ù����Ϊ�������
���������Ʊ��ܵ����������Ҫԭ�ϣ���ͼΪ��ˮ�ϲ����ܣ�CoC2O4•2H2O���ڿ��������ȵ������仯���ߣ�������300�漰�������ù����Ϊ��������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | O | B�� | Zn | C�� | N2 | D�� | CO |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com