
| 1000ρw% |
| M |
| m |
| M |
| n |
| V |
| 1000ρw% |
| M |
| 1000×1.385g/cm3×63% |
| 63 |
| m |
| M |
| 1.43g |
| 286g/mol |
| n |
| V |
| 0.01mol |
| 0.1L |
| 8.96L |
| 22.4L/mol |


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
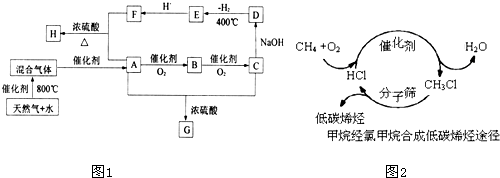
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验顺序 | 实验内容 | 实验现象 |
| ① | A+B | 没有现象发生 |
| ② | B+D | 有气体放出 |
| ③ | B+C | 有沉淀生成 |
| ④ | A+D | 有沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X基态原子中成对电子与未成对电子数之比为4:3 |
| Y | Y基态原子L层电子数是K层的3倍 |
| Z | Z元素在自然界中存在质量数为35和37的两种核素 |
| W | W为一种常见金属,能形成多种氧化物,其中有一种具有磁性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
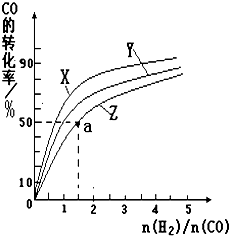 甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:| 1 |
| 2 |
| 1 |
| 2 |
| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com