

分析 (1)根据图示分析配制一定物质的量浓度的溶液的操作正误;
(2)容量瓶是确定溶液体积的仪器;
(3)根据仰视刻度线,会使溶液体积偏大判断.
解答 解:(1)由图示可知②⑤操作不正确,②不能在量筒中溶解固体,⑤定容时应平视刻度线,至溶液凹液面与刻度线相切,
故答案为:②⑤;
(2)应该用50mL容量瓶准确确定50mL溶液的体积,故答案为:50mL容量瓶;
(3)如果用图示的操作配制溶液,由于仰视刻度线,会使溶液体积偏大,所配制的溶液浓度将偏小,所测得草酸溶液的浓度将偏大,
故答案为:偏大.
点评 本题考查了配制一定物质的量浓度的溶液的方法,该题是中等难度的试题,试题基础性强,贴近高考;该题难易适中,注重灵活性,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力;该题的难点在于误差分析,注意明确误差分析的方法.


科目:高中化学 来源: 题型:解答题
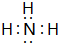 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| C-F | 427 | C-Cl | 330 | C-I | 218 |
| H-H | 436 | S=S | 255 | H-S | 339 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol${\;}_{8}^{16}$OD-含有的质子、中子数均为9NA | |
| B. | 3.6g石墨和C60的混合物中,含有的碳原子数为0.3NA | |
| C. | 含有4.6g钠元素的过氧化钠和氧化钠的混合物中,所含离子总数为0.3NA | |
| D. | 标准状况下,4.48L HF含有的分子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO4=Ba2++SO42- | B. | NaHSO4=Na++HSO4- | ||
| C. | H2SO4=2H++SO42- | D. | NaHCO3=Na++HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸的化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
| A. | 2CN-+H2O+CO2═2HCN+CO32- | |
| B. | 相同温度时,等物质的量浓度的各溶液pH关系:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| C. | 冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小 | |
| D. | 25℃时,等体积、等物质的量浓度的NaCN溶液中阴离子总数小于CH3COONa溶液中阴离子总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)检验食盐中是否加碘,可利用如下反应:
(1)检验食盐中是否加碘,可利用如下反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com