
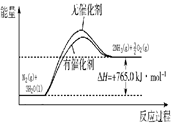
�˹��̵���ָ����Ԫ��������̬ת��Ϊ����̬�Ĺ��̡��ݱ���,���¡���ѹ������������,N2�ڲ��������������Ķ������Ѵ�����������ˮ������Ӧ�����ɵ���Ҫ����ΪNH3����Ӧ���Ȼ�ѧ����ʽΪ��N2(g)+3H2O(l) 2NH3(g)+
2NH3(g)+ O2(g) ��H="+765.0kJ" /mol��
O2(g) ��H="+765.0kJ" /mol��
��������ͼ��ʾ�������л���������Ӧ���д�����������������·�Ӧ��ϵ�е������仯ʾ��ͼ�������б�ע(������H)��

��Ŀǰ��ҵ�ϳɰ���ԭ���ǣ�N2(g)+
3H2(g) 2NH3(g) ��H=��93.0kJ /mol��
2NH3(g) ��H=��93.0kJ /mol��
�ش��������⣺
(1)������ȼ���ȡ�H=_______________kJ/mol��
(2)�ں��º����ܱ������н��еĺϳɰ���Ӧ�������ܱ�ʾ�ﵽƽ��״̬����_______(�����)��
a����������ѹǿ���ٷ����仯
b�����������ܶȲ��ٷ����仯
c����Ӧ������N2��NH3�����ʵ����ı�ֵ���ٷ����仯
d����λʱ���ڶϿ�a��H��H����ͬʱ�γ�3 a��N��H��
e���������ʵ�Ũ�ȱ�ǡ�õ��ڻ�ѧ����ʽ�и����ʵĻ�ѧ������֮��
(3)�ں��º��ݵ��ܱ������У��ϳɰ���Ӧ�ĸ�����Ũ�ȱ仯��������ͼ��ʾ����ش��������⣺
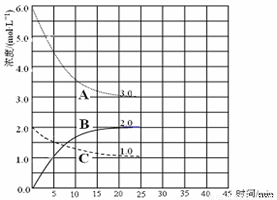
�� ��ʾN2��Ũ�ȱ仯�������� (ѡ�����ߴ��š�A������B����C��)��
�� ǰ25 min �ڣ���H2��Ũ�ȱ仯��ʾ�Ļ�ѧ��Ӧƽ�������� ��
����25 min ĩ��Ӧ�պôﵽƽ�⣬����¶��·�Ӧ��ƽ�ⳣ��K = (���������÷�����ʾ)���������¶ȣ��÷�Ӧ��ƽ�ⳣ��ֵ��_______(����� ����С�����䡱)��
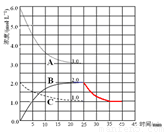
(4)�ڵ�25 min ĩ�����������������䣬�����߷�Ӧ�¶Ȳ��跨���ָ��¶Ȳ��䣬�ڵ�35 minĩ�ٴδﵽƽ�⡣ƽ���ƶ�������H2Ũ�ȱ仯��1.5 mol��L��1��������ͼ�л�����25 min �� 40 min NH3Ũ�ȱ仯���ߡ�
(5)��һ���¶��£���1 mol N2��3 mol H2����������������ܱ������з�����Ӧ���ﵽƽ��״̬ʱ��������������ʵ���Ϊ2.8 mol ��
�ٴ�ƽ��ʱ��H2��ת���ʦ�1 = ____________��
������ͬ�����£�����ʼʱֻ��NH3���ڸ������У��ﵽƽ��״̬ʱNH3��ת����Ϊ��2������1 + ��2 =1ʱ������ʼʱn (NH3)= ________mol��
 ��
��
��. (1)��286.0(1��)
(2) a c (ÿ��1�֣���2�֣��д����÷֡�)
(3)�� C (1��) �� 0.12 mol��L��1��min��1(2��)
�� 4/27 (��0.148��0.15) (2�֣�д��λҲ�÷�) ��С(1��)
(4)
(5)�� 60%(2��) �� 2(1��)
��������
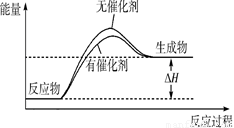
����������������Խ��ͷ�Ӧ�Ļ�ܣ��ӿ췴Ӧ���ʣ������ܸı䷴Ӧ�ȣ��ݴ˿�����ͼ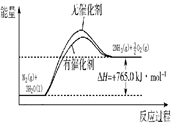 ��
��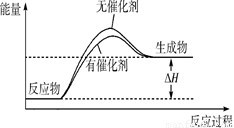 ��
��
��1�����ݸ�˹���ɿ�֪�����ڣ��٣���3���õ�H2(g)��1/2O2(g) H2O(l)�����Ը÷�Ӧ�ķ�Ӧ���ǡ�H������93.0kJ /mol��765.0kJ /mol����3����286.0 kJ /mol������������ȼ�����ǡ�H����286.0 kJ /mol��
H2O(l)�����Ը÷�Ӧ�ķ�Ӧ���ǡ�H������93.0kJ /mol��765.0kJ /mol����3����286.0 kJ /mol������������ȼ�����ǡ�H����286.0 kJ /mol��
��2����һ�������£������淴Ӧ������Ӧ���ʺ��淴Ӧ�������ʱ������Ϊ0������Ӧ��ϵ�и������ʵ�Ũ�Ȼ������ٷ����仯��״̬����Ϊ��ѧƽ��״̬������ѡ��c����˵�����÷�Ӧ�������С�Ŀ��淴Ӧ�����Ե�ѹǿ���ٷ����仯ʱ������˵����a��ȷ���ܶ��ǻ�����������������ݻ��ı�ֵ���ڷ�Ӧ�������������ݻ�ʼ���Dz���ģ�b����ȷ��D�з�Ӧ���ʵķ�������ͬ�ģ�����ȷ������֮������Ӧ�Ļ�ѧ������֮�ȣ����e�еĹ�ϵʼ���dz���������ȷ����˴�ѡac��
��3���ٸ���ͼ���֪����Ӧ���е�25minʱ���ʵ�Ũ�Ȳ��ٷ����仯����ʱABC��Ũ�ȱ仯���ֱ��ǣ�mol/L��A����3.0��B����2.0��C����1.0�����Ա�ʾN2��Ũ�ȱ仯��������C����ʾH2��Ũ�ȱ仯��������A����ʾ������Ũ�ȱ仯��������B��
��ǰ25 min �ڣ���H2��Ũ�ȱ仯��ʾ�Ļ�ѧ��Ӧƽ��������3.0mol/L��25min��0.12 mol��L��1��min��1��
�۸���ƽ�ⳣ���ı���ʽ��֪���÷�Ӧ��K��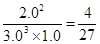 ����������Ӧ�Ƿ��ȷ�Ӧ�������������¶ȣ�ƽ�����淴Ӧ�����ƶ����÷�Ӧ��ƽ�ⳣ��ֵ����С��
����������Ӧ�Ƿ��ȷ�Ӧ�������������¶ȣ�ƽ�����淴Ӧ�����ƶ����÷�Ӧ��ƽ�ⳣ��ֵ����С��
��4�������¶ȣ���Ӧ��������ƽ�����淴Ӧ�����ƶ������Ը���������Ũ�ȱ仯����֪��ƽ��ʱ������Ũ��Ӧ����1.0mol/L�����Ը�ͼӦ���ǣ����𰸣���
��5���� N2(g)+
3H2(g) 2NH3(g)
2NH3(g)
��ʼ����mol�� 1 3 0
ת������mol�� x 3x 2x
ƽ������mol�� 1��x 3��3x 2x
��1��x��3��3x��2x��2.8
���x��0.6
����������ת������60%��
�ڦ�1 + ��2 ��1����������ת������40%����
N2(g)+ 3H2(g) 2NH3(g)
2NH3(g)
��ʼ����mol�� 0 0 y
ת������mol�� 0.2y 0.6y 0.4y
ƽ������mol�� 0.2y 0.6y y��0.4y
��0.2y��0.6y��y��0.4y��2.8
���y��2
���㣺������������Է�Ӧ���ʺ�ƽ��״̬��Ӱ�졢��Ӧ���ʺ�ƽ�ⳣ���Լ���Ӧ��ת���ʵ��йؼ���
�����������Ի�ѧ��Ӧ���ʺͻ�ѧƽ��Ϊ���壬�ص㿼��ѧ��������û���֪ʶ���ʵ������������������ۺ���ǿ�������߿������ڼ���ѧ����ѧϰ��Ȥ��ѧϰ��֪��������������ѧ����������������Ӧ�����������ѧ���Ĺ淶����������ѧϰЧ�ʡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ͨ�� |
| һ������ |
| c4(NH3)?c3(O2) |
| c2(N2)?c6(H2O) |
| c4(NH3)?c3(O2) |
| c2(N2)?c6(H2O) |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| 3 |
| 2 |


| 4 |
| 27 |
| 4 |
| 27 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�����ʡ�����ص���ѧ��������ѧ�ȣ�������ѧ������������ѧ�Ծ����������� ���ͣ������
(17��)�˹��̵���ָ����Ԫ��������̬ת��Ϊ����̬�Ĺ��̡��ݱ���,���¡���ѹ������������,N2�ڲ��������������Ķ������Ѵ�����������ˮ������Ӧ�����ɵ���Ҫ����ΪNH3����Ӧ���Ȼ�ѧ����ʽΪ��N2(g)+3H2O(l) 2NH3(g)+
2NH3(g)+ O2(g) ��H="+765.0kJ" /mol��
O2(g) ��H="+765.0kJ" /mol��
��������ͼ��ʾ�������л���������Ӧ���д�����������������·�Ӧ��ϵ�е������仯ʾ��ͼ�������б�ע(������H)��
��Ŀǰ��ҵ�ϳɰ���ԭ���ǣ�N2(g)+3H2(g) 2NH3(g) ��H=��93.0kJ /mol��
2NH3(g) ��H=��93.0kJ /mol��
�ش��������⣺
(1)������ȼ���ȡ�H=_______________kJ/mol��
(2)�ں��º����ܱ������н��еĺϳɰ���Ӧ�������ܱ�ʾ�ﵽƽ��״̬����_______(�����)��
a����������ѹǿ���ٷ����仯
b�����������ܶȲ��ٷ����仯
c����Ӧ������N2��NH3�����ʵ����ı�ֵ���ٷ����仯
d����λʱ���ڶϿ�a��H��H����ͬʱ�γ�3 a��N��H��
e���������ʵ�Ũ�ȱ�ǡ�õ��ڻ�ѧ����ʽ�и����ʵĻ�ѧ������֮��
(3)�ں��º��ݵ��ܱ������У��ϳɰ���Ӧ�ĸ�����Ũ�ȱ仯��������ͼ��ʾ����ش��������⣺
�� ��ʾN2��Ũ�ȱ仯�������� (ѡ�����ߴ��š�A������B����C��)��
�� ǰ25 min �ڣ���H2��Ũ�ȱ仯��ʾ�Ļ�ѧ��Ӧƽ�������� ��
����25 min ĩ��Ӧ�պôﵽƽ�⣬����¶��·�Ӧ��ƽ�ⳣ��K = (���������÷�����ʾ)���������¶ȣ��÷�Ӧ��ƽ�ⳣ��ֵ��_______(���������С�����䡱)��
(4)�ڵ�25 min ĩ�����������������䣬�����߷�Ӧ�¶Ȳ��跨���ָ��¶Ȳ��䣬�ڵ�35 minĩ�ٴδﵽƽ�⡣ƽ���ƶ�������H2Ũ�ȱ仯��1.5 mol��L��1��������ͼ�л�����25 min �� 40 min NH3Ũ�ȱ仯���ߡ�
(5)��һ���¶��£���1 mol N2��3 mol H2����������������ܱ������з�����Ӧ���ﵽƽ��״̬ʱ��������������ʵ���Ϊ2.8 mol ��
�ٴ�ƽ��ʱ��H2��ת������1 = ____________��
������ͬ�����£�����ʼʱֻ��NH3���ڸ������У��ﵽƽ��״̬ʱNH3��ת����Ϊ��2������1 + ��2 =1ʱ������ʼʱn (NH3)= ________mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ��ɽ��ʡ�����и�����һ��ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ������
�˹��̵���ָ����Ԫ��������̬ת��Ϊ����̬�Ĺ��̡�
I.���һЩ��ѧ���о����ø����ӵ����Ե�SCY�մɣ��ܴ���H+��ʵ�鵪�Ĺ̶�һ��ⷨ�ϳɰ����������˵�����������ת���ʡ��ܷ�ӦʽΪ��N2(g)��3H2(g)  2NH3(g)�����ڵ�ⷨ�ϳɰ��Ĺ����У�Ӧ��H2���ϵ�ͨ��_________����������������� ������һ�缫ͨ��N2���õ缫�ķ�ӦʽΪ__________________________��
2NH3(g)�����ڵ�ⷨ�ϳɰ��Ĺ����У�Ӧ��H2���ϵ�ͨ��_________����������������� ������һ�缫ͨ��N2���õ缫�ķ�ӦʽΪ__________________________��
II.�ݱ�������һ�������£�N2�ڲ��������������Ķ������Ѵ�����������ˮ������Ӧ����Ҫ����ΪNH3����Ӧ�ķ�Ӧ����ʽΪ��2N2(g)��6H2O(g) 4NH3(g)��3O2(g) ��H��Q��
4NH3(g)��3O2(g) ��H��Q��
��1��������Ӧ��ƽ�ⳣ������ʽΪ_______________��
��2��ȡ��ݵ����N2��H2O�Ļ�����壨���ʵ���֮�Ⱦ�Ϊ1��3�����ֱ���������ͬ�ĺ����ܱ������У����¶Ȳ���ͬ������·�����Ӧ����Ӧ��ͬʱ���õ������������ �뷴Ӧ�¶�T�Ĺ�ϵ������ͼ��ʾ����������Ӧ��Q________0�����������������=������
�뷴Ӧ�¶�T�Ĺ�ϵ������ͼ��ʾ����������Ӧ��Q________0�����������������=������

��3����������Ӧ���д���������·���������ͼ��ʾ��a��b��c��d���������У��ܱ�ʾ��Ӧ��ϵ�����仯����_______��ѡ����ĸ���ţ���ͼ�С�H�ľ���ֵΪ1530kJ��mol-1��

III.Ŀǰ��ҵ�ϳɰ���ԭ���ǣ�N2(g)��3H2(g)  2NH3(g) ��H����93.0kJ/mol��
2NH3(g) ��H����93.0kJ/mol��
�ش��������⣺
��1�����II�е����ݣ���O2(g)��2H2(g)��2H2O(g)�ġ�H��______________��
��2����һ���¶��£���1molN2��3mol H2����������������ܱ������з�����Ӧ���ﵽƽ��״̬ʱ��������������ʵ���Ϊ2.8mol��
�ٴ�ƽ��ʱ��H2��ת���ʦ�1��______________��
������ͬ�����£�����ʼʱֻ��NH3���ڸ������У��ﵽƽ��״̬ʱNH3��ת����Ϊ��2������1����2��1ʱ������ʼʱNH3�����ʵ���n(NH3)��_____________mol��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com