
【题目】图中的实验装置可用于制取乙炔。请填空:


(1)图中,A管的作用是 。制取乙炔的化学方程式是 。
(2)乙炔通入KMnO4酸性溶液中观察到的现象是 ,乙炔发生了 反应。
(3)乙炔通入溴的CCl4溶液中观察到的现象是 , 乙炔发生了 反应。
(4)为了安全,点燃乙炔前应 ,乙炔燃烧时的实验现象是 。
【答案】(1)调节水面的高度以控制反应的发生和停止;CaC2+2H2O=C2H2↑+Ca(OH)2
(2)KMnO4溶液褪色;氧化
(3)溴的CCl4溶液褪色;加成
(4)检查乙炔的纯度;火焰明亮并伴有浓烈的黑烟
【解析】
试题分析:(1)图示装置可通过调节A管的高度,控制反应的发生和停止:将A管提高,右管中水面上升,水与电石接触发生反应;将A管降低,右管中水面下降,水与电石脱离接触,反应停止,制取乙炔的化学反应方程式为CaC2+2H2O→Ca(OH)2+CH≡CH↑。
故答案为:调节水面的高度来控制反应的发生和停止;CaC2+2H2O→Ca(OH)2+CH≡CH↑;
(2)乙炔容易被高锰酸钾氧化,使高锰酸钾褪。
故答案为:高锰酸钾溶液褪色;氧化;
(3)乙炔能够和溴的四氯化碳溶液发生加成反应,使溴的四氯化碳溶液褪色。
故答案为:溴的四氯化碳溶液褪色;加成;
(4)点燃乙炔前应该先检验纯度,由于乙炔中含碳的质量分数较大,燃烧时火焰明亮并伴有浓烈的黑烟。
故答案为:检查乙炔的纯度;明亮火焰并伴有浓烈的黑烟。


科目:高中化学 来源: 题型:
【题目】乙烯雌酚是一种激素类药物,结构简式如图.请回答:
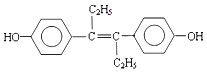
(1)乙烯雌酚中含氧官能团的名称是 .
(2)1mol乙烯雌酚最多能与 mol H2发生加成反应.
(3)下列关于乙烯雌酚的说法正确的是 (填序号).
①具有弱酸性 ②分子式为 C18H20O2 ③能与碳酸钠溶液反应放出二氧化碳
(4)乙烯雌酚发生加聚反应所得产物的结构简式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式________________________。
(2)根据元素周期律,原子半径Ga_____________As,第一电离能Ga____________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为____________________,其中As的杂化轨道类型为_________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_____________________。
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGag·mol-1和MAs g·mol-1,原子半径分别为rGapm和rAspm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 含有最低价元素的化合物不一定具有很强的还原性
B. 元素的单质一定是由氧化或还原该元素的化合物制得
C. 阳离子只能得电子被还原,阴离子只能失电子被氧化
D. 在化学反应中,得电子越多的氧化剂,其氧化性就越强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由A、B、C、D四种金属按下表中装置图进行实验.

根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是_____________________________________.
(2)装置乙中正极的电极反应式是____________________________________..
(3)四种金属活泼性由强到弱的顺序是__________________________________.
(4)A、C形成合金,露置在潮湿空气中,_______先被腐蚀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜器久置于空气中会和空气中的水蒸气、CO2、O2作用产生“绿锈”,该“绿锈”俗称“铜绿”,又称“孔雀石”[化学式为Cu2(OH)2CO3],“铜绿”能跟酸反应生成铜盐和CO2、H2O。某同学利用下述系列反应实现了“铜→铜绿→……→铜”的转化。
![]()
(1)从三种不同分类标准回答,“铜绿”属于哪类物质? _。
(2)请写出铜绿与盐酸反应的化学方程式: 。
(3)写出B的化学式 。
(4)上述转化过程中属于化合反应的是 ,属于复分解反应的是 (填序号)。
(5)写出①反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程:

⑴ KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列 物质相似。
A.75%酒精 B.双氧水 C.苯酚 D.“84”消毒液(NaClO溶液)
⑵ 铋酸钠(NaBiO3,不溶于水)用于定性检验酸性溶液中Mn2+的存在(铋元素的还原产物为Bi3+,Mn的氧化产物为+7价),写出反应的离子方程式: 。
⑶ 写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式: 。
⑷ 向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是 。
⑸ 上述流程中可以循环使用的物质有石灰、CO2、 和 (写化学式)。
⑹ 若不考虑物质循环与制备过程中的损失,则1mol MnO2可制得 mol KMnO4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】内锌矿的主要成分为ZnS,含有杂质PbS、CuS、FeS、SiO2等,以闪锌矿制备氯化锌的流程如图所示。

请回答下列问题:
(1)配制氯化铁浸渍液时要求pH为0.8~1之间,pH太高则 ,pH太低,浸渍矿石会产生有害气体 ,操作①是 。由氯化锌溶液制备氯化锌晶体的方法是 。
(2)高沸点溶剂R—4E几乎不溶于水,120℃时硫在R—4E里的溶解度为365g,室温时溶解度为35.9g,从浸出液B提取硫的方法是 。硫是工业制备硫酸的原料,现有1吨矿石,硫的总含量为24%,最多制备浓度98%的硫酸 吨。
(3)氯化铁与硫化锌发生反应:![]() ,则氯化铁与FeS反应的方程式为 。
,则氯化铁与FeS反应的方程式为 。
(4)溶液X的成分的化学式为 ,该流程中循环使用的物质是 。
(5)由氯化亚铁溶液制备氯化铁溶液,可以用![]() 、
、![]() ,但生产成本高。酸性条件下,使用催化剂在50℃左右通入氧气转化的成本极低,反应的离子方程式为 。
,但生产成本高。酸性条件下,使用催化剂在50℃左右通入氧气转化的成本极低,反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com