
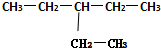 系统命名法:3-乙基戊烷
系统命名法:3-乙基戊烷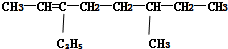 系统命名法:6-甲基-3-乙基-2-辛烯
系统命名法:6-甲基-3-乙基-2-辛烯分析 (1)该有机物主链为戊烷,在3号C含有1个乙基,据此写出该烷烃的名称;
(2)该烃为烯烃,碳碳双键在2号C,在3号C含有1个乙基,在6号C含有1个甲基,据此写出其名称;
(3)主链为1-戊炔,在3号C含有1个甲基,据此写出该炔烃的结构简式;
(4)依据0.1mol该烃充分燃烧可以生成7.2g水计算判断含有氢原子数,结合烯烃的通式写出其分子式,然后判断其存在的结构简式.
解答 解:(1)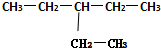 为烷烃,主链为戊烷,在3号C含有1个乙基,其名称为:3-乙基戊烷,
为烷烃,主链为戊烷,在3号C含有1个乙基,其名称为:3-乙基戊烷,
故答案为:3-乙基戊烷;
(2)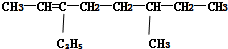 为烯烃,碳碳双键在2号C,在3、6号C分别含有1个甲基、1个乙基,该有机物名称为:6-甲基-3-乙基-2-辛烯,
为烯烃,碳碳双键在2号C,在3、6号C分别含有1个甲基、1个乙基,该有机物名称为:6-甲基-3-乙基-2-辛烯,
故答案网为:6-甲基-3-乙基-2-辛烯;
(3)根据命名原则,含有-C≡C-的碳链有5个碳原子,三键处于端位置,从-C≡C-双键一端编号,甲基处于3号碳原子上,3-甲基-1-戊炔的结构简式为:HC≡CCH(CH3)CH2CH3,
故答案为:HC≡CCH(CH3)CH2CH3;
(4)(1)0.1mol该烃充分燃烧可以生成7.2g水,物质的量=$\frac{7.2g}{18g/mol}$=0.4mol,所以1mol烃反应生成水4mol,说明烃分子中含有8molH,该链状单烯烃为C4H8,为丁烯,丁烯可能的结构简式为:CH2=CHCH2CH3、CH3CH=CHCH3、CH2=CH(CH3)CH2,
故答案为:C4H8;CH2=CHCH2CH3、CH3CH=CHCH3、CH2=CH(CH3)CH2.
点评 本题考查了有机物分子式、结构简式的确定、有机物的命名,题目难度中等,注意掌握常见有机物结构与性质,明确同分异构体的书写原则及常见有机物的命名原则.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:选择题
| A. | 酸雨就是指pH<7的雨水 | |
| B. | 工业上大量燃烧含硫燃料和以含硫矿石为原料冶炼金属产生的SO2是产生硫酸型酸雨的主要原因 | |
| C. | 酸雨是因为雨水中含有CO2 | |
| D. | 酸雨没有危害,所以不必担心,也不必想办法治理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H、D、T互为同素异形体 | |
| B. | 含有共价键的化合物一定是共价化合物 | |
| C. | NH4Cl的电子式: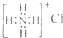 | |
| D. | S2-的结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
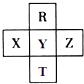 元素R、T、X、Y、Z在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸,生成HR.则下列判断正确的是( )
元素R、T、X、Y、Z在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸,生成HR.则下列判断正确的是( )| A. | 非金属性:Z<Y<X | |
| B. | R与Y的电子数相差8 | |
| C. | 气态氢化物稳定性:HR<HY<HT | |
| D. | 最高价氧化物的水化物的酸性:HTO4>HYO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Co2+ | 6.9 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
 3×10-8mol•L-1)
3×10-8mol•L-1)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
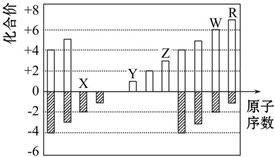
| A. | 原子半径:Z>Y>X | |
| B. | 气态氢化物的稳定性:R<W | |
| C. | WX2和水反应形成的化合物是一种强酸 | |
| D. | Y和Z两者最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 事实 | 推测 | |
| A | ${\;}_{12}^{\;}$Mg与水反应缓慢,${\;}_{20}^{\;}$Ca与水反应较快 | ${\;}_{56}^{\;}$Ba(DA族)与水反应会更快 |
| B | 是半导体材料,同族的Ge也是半导体材料 | Ⅳ族的元素都是半导体材料 |
| C | HCl在1500℃时分解,HI在230℃时分解 | HBr的分解温度介于二者之间 |
| D | Si与H2高温时反应,S与H2加热能反应 | P与H2在高温时能反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
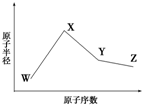 已知W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X、Y、Z同周期,其中X的M层电子数是K层的一半;Y的单质是一种常见的半导体
已知W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X、Y、Z同周期,其中X的M层电子数是K层的一半;Y的单质是一种常见的半导体查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com